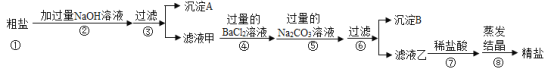
题目内容
【题目】元素周期表是学习化学的重要工具。如图是元素周期表的一部分,根据所学知识回答下列问题。
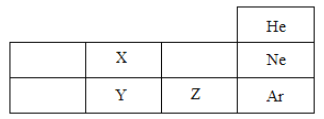
(1)X、Y、Z代表三种不同元素,下列判断错误的是______。
A.原子序数Z>Y
B.核外电子数Y=X+8
C.Y和Z处于同一族
(2)由X元素和Y元素组成的化合物的化学式为______;
(3)R2+与Ne的核外电子排布相同,则R的元素符号是__,它处在元素周期表中第__周期。
【答案】C SO2或SO3 Mg 三
【解析】
(1)A、由左至右原子序数依次增大,因此原子序数Z>Y,该选项说法正确;
B、核外电子数Y=X+8,该选项说法正确;
C、Y和Z不处于同一族,处在同一周期,该选项说法不正确。 故填:C。
(2)由X元素(氧元素)和Y元素(硫元素)组成的物质中,氧元素化合价是-2,硫元素化合价可能是+4,也可能是+6,根据化合物中元素化合价代数和为零可知,形成的化合物的化学式是SO2或SO3。 故填:SO2或SO3。
(3)R2+与Ne的核外电子排布相同,则R是镁元素,镁元素的元素符号是Mg,镁元素核外电子层数是3,它处在元素周期表中第三周期。 故填:Mg;三。

 阅读快车系列答案
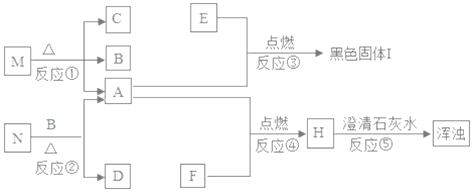
阅读快车系列答案【题目】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
(提出问题)过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
(查阅资料) ①人呼出的气体中主要成分是N2.O2.CO2和水蒸气等。
②CO2 + 2NaOH = Na2CO2 + H2O。
(提出猜想)过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
(进行实验)
实验 Ⅰ:验证过氧化钠与氮气反应并生成氧气。
(1)实验操作如图1所示。
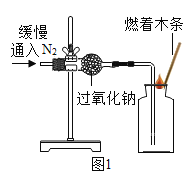
(2)实验现象及结论:观察到_________ 现象 ,判断过氧化钠与氮气没有发生反应。
实验 Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
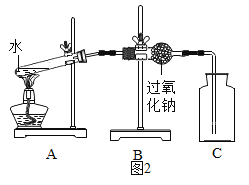
(1)同学们在老师的指导下设计了如图2所示装置。其中A装置的作用是________,发生的变化是______变化。
(2)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
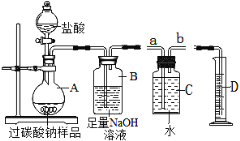
实验 Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
(1)同学们在老师的指导下设计了如图3所示装置。(提示:C装置中的氢氧化钠溶液用于吸收可能未反应的二氧化碳)
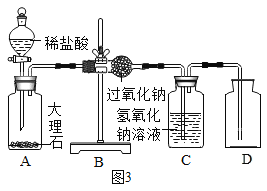
(2)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性。向装置中加入药品 | 装置的气密性良好。 | |
② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸 | A装置中观察到的现象有_____,C装置中有气泡出现。 | A装置中发生反应的化学方程式为____; |
③ | 一段时间后用带火星的木条在D内进行检验。 | 带火星的木条复燃 | 过氧化钠与二氧化碳反应并生成氧气 |
(实验反思)
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是________(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是____________________。