题目内容
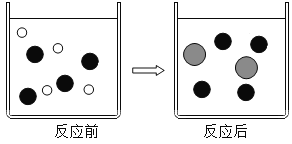
【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。

(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
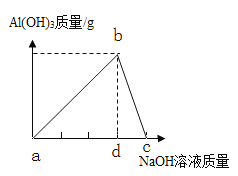
(提出猜想)猜想1:Na2SO4、NaCl;猜想2:Na2SO4、NaCl和________;猜想3:Na2SO4、NaCl和H2SO4;猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是______(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入一定量氧化铜固体 | ______ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入适量的硝酸钡溶液 | 产生白色沉淀 |
请写出方案一中有关反应的化学方程式:________。
(反思与总结)(1)有同学认为方案二不合理,分析原因_________。
(2)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。
【答案】Na2CO3 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 黑色固体消失,溶液由无色变为蓝色 CuO+H2SO4=CuSO4+H2O 在猜想3中有Na2SO4,也会与Ba(NO3)2反应产生白色沉淀,无法证明是否有H2SO4
【解析】
[提出猜想]根据分析可知,猜想1:盐酸和碳酸钠、稀硫酸和氢氧化钠都恰好完全反应:Na2SO4、NaCl;猜想2:碳酸钠过量时:Na2SO4、NaCl和Na2CO3;猜想3:稀硫酸过量时:Na2SO4、NaCl和H2SO4;猜想4:Na2SO4、NaCl、H2SO4和Na2CO3;
[交流讨论]小强同学认为猜想4一定是错误的,理由是碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
[进行实验]取少量烧杯中的溶液于洁净的试管中,加入一定量氧化铜固体,氧化铜和硫酸反应生成硫酸铜和水,若观察到黑色固体消失,溶液由无色变为蓝色,说明含有硫酸;
方案一中,氧化铜和硫酸反应生成硫酸铜和水,反应的化学方程式:CuO+H2SO4=CuSO4+H2O;
[反思与总结](1)硫酸钠和硝酸钡反应也生成硝酸钡沉淀和硝酸钠,所以无法证明是否有H2SO4。

【题目】“低钠盐”可以控制钠的摄入量从而防止高血压等疾病。国内某些生产厂家为改变“低钠盐”的口味,还会在“低钠盐”中加入少量的镁盐(MgSO4或MgCl2中的一种)。某兴趣小组的同学对某“低钠盐”样品中添加的镁盐的成分进行如下探究:
[提出问题]该“低钠盐”中添加了哪种镁盐?
[猜想与假设]猜想1:添加了MgCl2
猜想2:添加了MgSO4
[设计实验]
实验操作 | 实验现象 | 实验目的或结论 |
步骤1:取少量“低钠盐”充分溶解后,加入足量_____溶液 | _____。 | 除尽溶液中的镁离子 |
步骤2:取少量步骤1所得的上层清液,向其中加入适量_____溶液 | 有白色沉淀生成 | 猜想2正确 |
写出步骤2中发生反应的化学方程式_____。
[拓展与应用]若将NaCl溶液中含有的少量MgSO4除去,下列提供的试剂中,可选用的是_____ ( 填字母)。
A NaOH溶液
B BaCl2 溶液
C AgNO3溶液
D Ba(OH)2溶液