题目内容
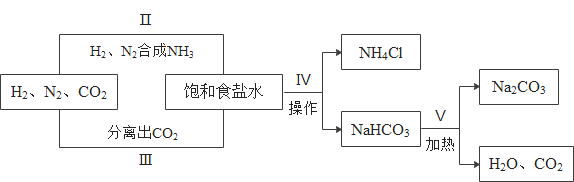
【题目】A~H分别是由氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质(如“题图”所示,箭头表示物质间能转化,实线表示物质间能反应)。请回答:
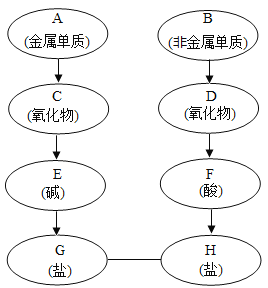
(1)氧化物C可以是_____或_____。
(2)若B常温下为固态,则B是_____,H的化学式为_____。
(3)若F是硝酸,则E与F反应的化学方程式为_____。
(4)G与H反应的化学方程式为_____。
(5)本题中的A选择不同的金属会对F是哪一种酸造成影响,原因是_____。
【答案】氧化钠(Na2O) 氧化钙(CaO) 碳(或C) Na2CO3 ![]()
![]() 因为盐G与盐H反应必须符合复分解反应的条件:G与H均可溶且生成的新盐中要有沉淀;而G是由金属A决定其组成的,若A是钠则G是钠盐,则H必须是Ca(NO3)2,即F是HNO3;同理,若A是钙则G是钙盐,则H必须是Na2CO3,即F是H2CO3
因为盐G与盐H反应必须符合复分解反应的条件:G与H均可溶且生成的新盐中要有沉淀;而G是由金属A决定其组成的,若A是钠则G是钠盐,则H必须是Ca(NO3)2,即F是HNO3;同理,若A是钙则G是钙盐,则H必须是Na2CO3,即F是H2CO3
【解析】
解:A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质,若B常温下为固态,又是非金属单质,所以B是碳,碳转化成的氧化物又会生成酸,所以D是二氧化碳,F是碳酸,H是碳酸钠;若F是硝酸,还有后面B可以转化成氧化物,再转化为酸可以推出B是N2,D为NO2,得到的酸F是硝酸,盐H是硝酸盐,这里的硝酸盐只能是硝酸钙,另一种盐G为碳酸钠,A、C、E分别为钠或钙、氧化钠或氧化钙、氢氧化钠或氢氧化钙,经过验证,推导正确,所以
(1)氧化物C可以是氧化钠或氧化钙;
(2)若B常温下为固态,则B是碳,H的化学式为Na2CO3;
(3)若F是硝酸,E与F的反应是氢氧化钠和硝酸反应生成硝酸钠和水,化学方程式为:NaOH+HNO3=NaNO3+H2O;
(4)G与H的反应是硝酸钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3;
(5)本题中的A选择不同的金属会对F是哪一种酸造成影响,原因是:因为盐G与盐H反应必须符合复分解反应的条件:G与H均可溶且生成的新盐中要有沉淀;而G是由金属A决定其组成的,若A是钠,则G是钠盐,则H必须是Ca(NO3)2,即F是HNO3;同理,若A是钙则G是钙盐,则H必须是Na2CO3,即F是H2CO3。
故答案为:(1)氧化钠(Na2O)氧化钙(CaO);
(2)碳(或C);Na2CO3;
(3)NaOH+HNO3=NaNO3+H2O;
(4)Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3;
(5)因为盐G与盐H反应必须符合复分解反应的条件:G与H均可溶且生成的新盐中要有沉淀;而G是由金属A决定其组成的,若A是钠,则G是钠盐,则H必须是Ca(NO3)2,即F是HNO3;同理,若A是钙,则G是钙盐,则H必须是Na2CO3,即F是H2CO3。

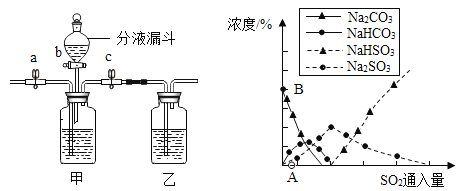
【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。

(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;猜想2:Na2SO4、NaCl和________;猜想3:Na2SO4、NaCl和H2SO4;猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是______(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入一定量氧化铜固体 | ______ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入适量的硝酸钡溶液 | 产生白色沉淀 |
请写出方案一中有关反应的化学方程式:________。
(反思与总结)(1)有同学认为方案二不合理,分析原因_________。
(2)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
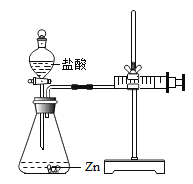
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_______________________.
从实验现象可判断:金属活动性Zn_______Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_______.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是_______.
所用药品、实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是_________________.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是_________________________.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】________________________________.
【实验方案】_____________________________.