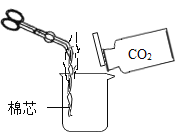
题目内容
【题目】氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)增大压强, HCl由气态变为液态, 从微观的角度分析该变化过程中改变的是____。
(2)在盐酸中加入过量的铁粉充分反应。如图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号):
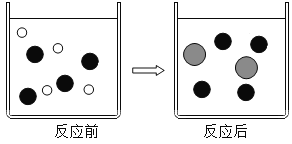
![]() _____、
_____、![]() ____、
____、![]() ____。
____。
(3)取 2 支试管,分别开展如下实验:
实验 I:在充满 HCl 气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水。
实验 II:在充满CO2气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水。
实验 I 和实验 II 滴入水后的现象为:_______。
(4)向盛有Na2CO3粉末的试管中通入 HCl 气体,无明显现象;停止通气,再加入少量水,现象是___________,写出该反应的化学方程式_____。
(5)结合(3)与(4)中有关的实验与现象,下列有关 HCl 气体和盐酸中说法正确的是: _____
a.HCl 气体和盐酸具有完全相同的化学性质;
b.HCl 气体中含有氢离子;
c.向盛有CaCO3固体的试管中滴入稀盐酸,能放出使澄清石灰水变浑浊的气体;
d.HCl 气体和CO2气体通入水后均产生了氢离子
【答案】分子的间隔 H+ Cl- Fe2+ 染有石蕊的纸条变红色 白色粉末溶解,溶液中气泡逸出(没有写粉末溶解不扣分) ![]() cd
cd
【解析】
根据物质的三态变化是分子间间隔的改变,利用酸的电离及酸的通性相关知识进行作答。
(1)增大压强, HCl由气态变为液态,是物理变化,分子本身是不变的,只是分子间的间隔变小;
(2)在盐酸中加入过量的铁粉充分反应。其反应化学方程式是:![]() 。反应前盐酸溶液中的离子是H+、Cl-,反应后溶液中的离子是Cl-、Fe2+,反应前后是Cl-都有,对照图片:
。反应前盐酸溶液中的离子是H+、Cl-,反应后溶液中的离子是Cl-、Fe2+,反应前后是Cl-都有,对照图片:![]() 是Cl-,则
是Cl-,则![]() 是H+、
是H+、![]() 是Fe2+;
是Fe2+;
(3)实验 I:在充满 HCl 气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象,因为氯化氢气体中没有氢离子和氯离子,不是酸;再滴入水,氯化氢气体极易溶于水,形成了盐酸,产生了H+、Cl-,所以盐酸使染有石蕊的纸条变红色;
实验 II:在充满 CO2 气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象,因为二氧化碳不是酸;再滴入水,CO2和水发生反应生成碳酸,碳酸使染有石蕊的纸条变红色;
(4)向盛有 Na2CO3 粉末的试管中通入 HCl 气体,无明显现象,因为氯化氢气体中没有氢离子和氯离子,不是酸;停止通气,再加入少量水,氯化氢气体极易溶于水,产生了H+、Cl-,形成了盐酸,则盐酸与Na2CO3反应产生大量的气泡,同时Na2CO3 粉末减少至消失,该反应的化学方程式;![]() ;
;
(5)结合(3)与(4)中有关的实验与现象,进行
a.HCl 气体是分子构成的,盐酸中含有的是H+、Cl-,结构不同,化学性质不同,不符合题意;
b.HCl 气体是氯化氢分子构成的,不符合题意;
c.CaCO3 固体中滴入稀盐酸,两者反应:![]() ,二氧化碳能使澄清石灰水变浑浊,符合题意;
,二氧化碳能使澄清石灰水变浑浊,符合题意;
d.HCl 气体溶于水,形成了盐酸,产生了H+、Cl-,CO2 气体通入水后,CO2和水发生反应生成碳酸,碳酸电离产生了H+,符合题意。故选cd。

 互动英语系列答案
互动英语系列答案【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。

(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;猜想2:Na2SO4、NaCl和________;猜想3:Na2SO4、NaCl和H2SO4;猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是______(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入一定量氧化铜固体 | ______ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入适量的硝酸钡溶液 | 产生白色沉淀 |
请写出方案一中有关反应的化学方程式:________。
(反思与总结)(1)有同学认为方案二不合理,分析原因_________。
(2)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。
【题目】自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。
①金属镁的物理性质:__________(写一条);
②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为___________。
(2)第二站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤溶液中提取镁,流程如下:

流程中操作a为_________,步骤中Mg(OH)2与加入的X发生中和反应,请写出相关的化学方程式______。
(3)第三站:再探金属镁。
(提出问题)镁能否与热水反应 ? 如果反应,产物是什么?
(相关信息)①Mg+2H2O=Mg(OH)2+H2↑②氢氧化镁在热水中能部分溶解,液体呈碱性。
实验操作 | 实验现象 | 实验结论 |
①将打磨好的镁条放入盛有热水的试管中,收集气体并将气体点燃; | ①气体能被点燃,产生淡蓝色的火焰; | 镁能与热水反应,生成氢氧化镁和氢气 |
②反应后向试管中滴入酚酞试液 | ②________ |