题目内容
【题目】硫酸是用途广泛的化工原料,下图是以黄铁矿(FeS2)为原料生产硫酸的主要流程。
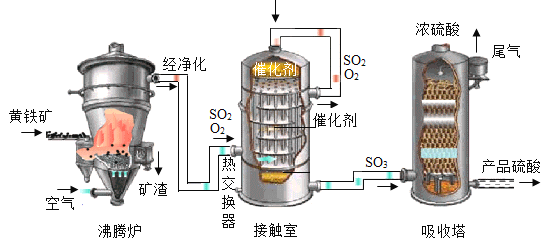
(1)粉碎黄铁矿的目的是_________。
(2)写出以上过程中,硫元素化合价为+6的物质的化学式__________。
(3)在一定条件下,接触室中发生反应的化学方程式为_________。
【答案】增大接触面积,使原料充分混合/反应更充分 SO3、H2SO4 
【解析】
(1)反应物接触面积越大,反应越剧烈,黄铁矿粉碎会增大反应物的接触面积,加快反应速度;
(2)根据在化合物中正负化合价代数和为零,硫元素化合价是+6价,该物质是三氧化硫,化学式为SO3;
(3)沸腾炉中生成的二氧化硫气体和空气中的氧气在接触室内发生的催化氧化反应生成三氧化硫,反应的化学方程式为: 。
。

 阅读快车系列答案
阅读快车系列答案【题目】已知:20℃时,a和b的溶解度分别为36g和88g。
| 序号 | ① | ② | ③ | ④ | ⑤ |
|
固体种类 | a | a | b | b | b | ||
固体的质量/g | 30 | 60 | 30 | 60 | 90 | ||
水的质量/g | 100 | 100 | 100 | 100 | 100 |
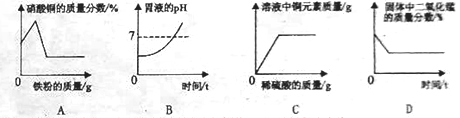
下列说法不正确的是
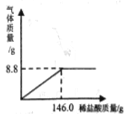
A.20℃时,⑤中溶质与溶剂的质量比为88:100
B.将t1℃时b的饱和溶液加水可变为不饱和溶液
C.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变
D.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等
【题目】某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。

(查阅资料)Na2SO4溶液、NaCl溶液呈中性。
(提出猜想)猜想1:Na2SO4、NaCl;猜想2:Na2SO4、NaCl和________;猜想3:Na2SO4、NaCl和H2SO4;猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
(交流讨论)小强同学认为猜想4一定是错误的,他的理由是______(用化学方程式表示)。
(进行实验)小明同学设计如下两个实验方案:
实验步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中,加入一定量氧化铜固体 | ______ | 猜想3正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中,加入适量的硝酸钡溶液 | 产生白色沉淀 |
请写出方案一中有关反应的化学方程式:________。
(反思与总结)(1)有同学认为方案二不合理,分析原因_________。
(2)分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。