题目内容
【题目】实验是化学的基础,兴趣是学习最好的老师。
探究一 气体的制取
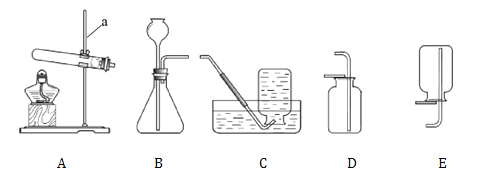
(1)仪器a的名称是________。
(2)实验室制取二氧化碳应选用的收集装置是________(填字母序号),将________接近集气瓶口,若观察到木条熄灭,说明二氧化碳已收集满。
(3)若装置A用于实验室制取氧气,则反应化学方程式是_____。
探究二 空气中氧气的含量的测定
冬季取暖人们常用到暖宝宝(下图),其热量来源于铁的缓慢氧化。化学小组的同学突发奇想,想利用暖宝宝测定空气中氧气的含量。

【资料查阅】:
1.暖宝宝的主要成分铁粉、木炭、食盐。
2.暖宝宝反应的主要原理是铁粉与氧气、水共同作
用生成氢氧化铁(化学式为Fe(OH)3)。
【设计实验】:化学小组的同学设计了下图1所示装置(广口瓶中水的变化对实验的影响忽略不计)。实验步骤如下:

①检查装置气密性
②向250mL集气瓶中加入20mL水
③读取温度计示数为18oC,撕掉暖宝宝上的贴纸,塞紧橡胶塞。
④观察温度计示数的变化
⑤待温度计示数为18oC时,打开止水夹。
【分析讨论】:
(4)写出暖宝宝反应主要原理的反应化学方程式_____________________。
(5)检查装置气密性的方法是_____________________________________。
(6)小组同学的设计中,集气瓶内水的作用是_______________________。
(7)实验结果如图2所示,则小组同学得出空气中氧气的体积分数为__________(精确到0.1%)。
【实验反思】:
(8)反思实验过程,你认为小组同学实验产生误差的可能原因有______________(写出一条即可)。
(9)你证明这确实是造成误差原因的方案是____________________。
【答案】 铁架台 D 燃着的木条 2KMnO4![]() K2MnO4 + MnO2 + O2↑ 4Fe + 6H2O + 3O2 === 4Fe(OH)3 将导气管放入水中,双手捂住集气瓶,观察到有气泡冒出,松开手,导管内有液柱,证明气密性良好 反应物 19.1% 暖贴内铁粉的量不够,O2没有完全被消耗 取两片暖贴重复上述实验
K2MnO4 + MnO2 + O2↑ 4Fe + 6H2O + 3O2 === 4Fe(OH)3 将导气管放入水中,双手捂住集气瓶,观察到有气泡冒出,松开手,导管内有液柱,证明气密性良好 反应物 19.1% 暖贴内铁粉的量不够,O2没有完全被消耗 取两片暖贴重复上述实验
【解析】本题考查了仪器名称,实验室制取氧气和二氧化碳收集装置和发生装置的选择,利用铁的生锈测定空气中氧气的含量。气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关。通过“资料查阅”,弄清暖宝宝反应的主要原理,结合课文中测定空气中氧气的含量方法进行分析。
(1)仪器a的名称是铁架台;
(2)二氧化碳能溶于水,密度比空气大,一般采用向上排空气法收集,实验室制取二氧化碳应选用的收集装置是D,二氧化碳一般不能燃烧也不能支持燃烧,将燃着的木条接近集气瓶口,若观察到木条熄灭,说明二氧化碳已收集满;
(3)装置A属于固体加热型,试管口有一团棉花,用于实验室制取氧气,应用高锰酸钾加热,高锰酸钾加热时生成锰酸钾和二氧化锰和氧气,反应化学方程式是:2KMnO4 ![]() K2MnO4 + MnO2 + O2↑;
K2MnO4 + MnO2 + O2↑;
(4)根据“资料查阅”可知:暖宝宝反应的主要原理是铁粉与氧气、水共同作用生成氢氧化铁(化学式为Fe(OH)3)。暖宝宝反应主要原理的反应化学方程式是:4Fe + 6H2O + 3O2 === 4Fe(OH)3
(5)检查装置气密性的方法是:将导气管放入水中,双手捂住集气瓶,观察到有气泡冒出,松开手,导管内有液柱,证明气密性良好;
(6)根据“资料查阅”可知:暖宝宝反应的主要原理是铁粉与氧气、水共同作用生成氢氧化铁(化学式为Fe(OH)3)。集气瓶内水的作用是反应物;
(7)实验前,集气瓶内空气的体积为(250-20)ml=230mL,实验前量筒内水的体积为100ml,实验后结束后,量筒内的水的体积为56ml,减少了44mL,这些水进入了集气瓶内,这些水的体积即为被消耗的氧气的体积,即44mL.所以空气中氧气的体积分数是![]() ×100%=19.1%;
×100%=19.1%;
(8)实验产生误差的可能原因有:暖贴内铁粉的量不够,O2没有完全被消耗
(9)你证明这确实是造成误差原因的方案是:取两片暖贴重复上述实验。

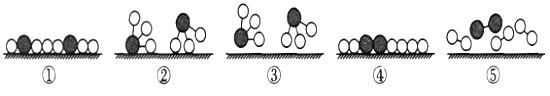
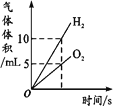
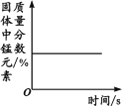
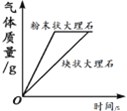
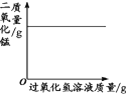
【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
A.将水通电电解一 段时间 | B.加热一定量的高 锰酸钾固体 | C.向两份相等质量的块状大理石和粉末状大理石中分别加入过量的等浓度的稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D