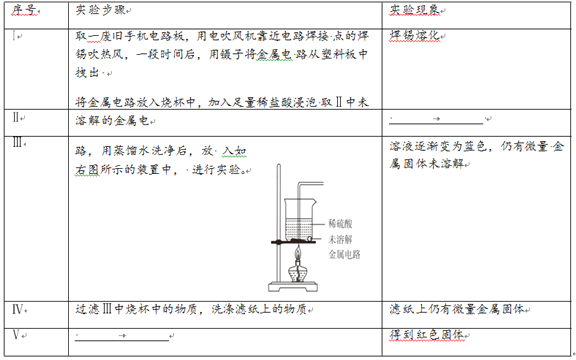
题目内容
【题目】工业上常用高温煅烧石灰石的方法来制得生石灰,发生的反应为CaCO3 ![]() CaO + CO2↑。现取一定量的石灰石样品进行煅烧(假设杂质质量不变),某变量y随时间的变化趋势如下图所示。则纵坐标表示的是
CaO + CO2↑。现取一定量的石灰石样品进行煅烧(假设杂质质量不变),某变量y随时间的变化趋势如下图所示。则纵坐标表示的是
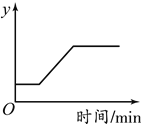
A. 生成CO2的体积 B. 生成CaO的质量
C. 固体中杂质的质量分数 D. 固体中氧元素的质量
【答案】C
【解析】A、碳酸钙高温煅烧后生成氧化钙、二氧化碳,开始固体中不含二氧化碳,应从零开始,错误;B、碳酸钙高温煅烧后生成氧化钙、二氧化碳,开始固体中不含氧化钙,应从零开始,错误;C、高温煅烧碳酸钙达到分解温度才开始分解,反应开始后,碳酸钙的质量减少,生成二氧化碳,所以固体总质量减少,但杂质不变,所以固体中杂质的质量分数会增大,当碳酸钙完全分解后,质量分数不再变化,正确;D、碳酸钙高温煅烧后生成氧化钙、二氧化碳,根据质量守恒定律反应前后氧元素的质量不变,反应前碳酸钙中氧元素的质量分数为:48/100×100%=48%,反应后,氧化钙中氧元素的质量分数为:16/56×100%≈28.6%,固体中氧元素的质量分数减小,氧元素的质量减少,错误;故选C。

练习册系列答案
相关题目