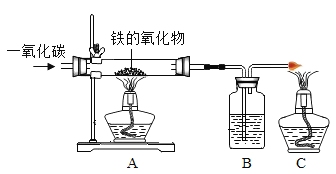
题目内容
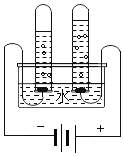
【题目】某校化学兴趣小组同学利用数字化传感器探究稀盐酸和氢氧化钠的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。

(1)根据图示可知:该实验是用胶头滴管逐滴将______(填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中至过量,反应的化学方程式为________。
(2)在b点时,溶液中溶质的化学式为_________。
(3)在实验过程中,同学们发现溶液中有少量气泡产生。
(提出问题)为什么会有气泡产生?
(作出猜想)甲同学认为氢氧化钠溶液已经变质,乙同学认为氢氧化钠溶液没有变质。你认为乙同学作出这种猜测的理由是_________。
(设计实验)为确定氢氧化钠溶液是否变质,同学们设计如下实验方案:
操作步骤 | 实验现象 | 实验结论 |
①取少量氢氧化钠溶液样品于试管中,加入过量的_____溶液,振荡,静置 | 有白色沉淀生成 | 氢氧化钠溶液 部分变质 |
②取①中上层清液,加入无色酚酞溶液 | ______ |
(交流反思)氢氧化钠暴露在空气中容易变质,故应_______保存。
【答案】稀盐酸 NaOH+HCl=NaCl+H2O NaCl 中和反应过程会放出热量,使溶解于水中的气体的溶解度降低 BaCl2或CaCl2 溶液变红 密封
【解析】
(1)由图可知溶液由碱性溶液(pH>7)变为了酸性溶液(pH<7),故实验是用胶头滴管逐滴将稀盐酸滴加到另一种溶液中至过量。氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式为NaOH+HCl=NaCl+H2O,故填:稀盐酸;NaOH+HCl=NaCl+H2O。
(2)在b点时,pH=7,稀盐酸和氢氧化钠恰好完全反应,溶液中溶质为氯化钠,故填:NaCl。
(3)中和反应过程会放出热量,使溶解于水中的气体的溶解度降低,所以也会产生气泡,故乙同学认为氢氧化钠溶液没有变质,故填:中和反应过程会放出热量,使溶解于水中的气体的溶解度降低,所以也会产生气泡。
[设计实验]证明氢氧化钠有没有变质,可先取少量氢氧化钠溶液样品于试管中,加入过量的BaCl2或CaCl2溶液,振荡,静置如果有白色沉淀生成,则说明溶液中有碳酸钠,氢氧化钠溶液变质,接着取第一步中上层清液,加入无色酚酞溶液,溶液变红色,则说明溶液中有氢氧化钠,证明氢氧化钠溶液部分变质,故填:BaCl2或CaCl2;溶液变红色。
[交流反思]氢氧化钠暴露在空气中容易变质,故应密封保存,故填:密封。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】请从A~D中任选三个作答,若均作答,按前三个计分。
实验目的 | 实验 | 回答问题 |
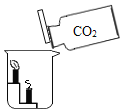
A 验证二氧化碳的密度比空气大 |
| 该实验除了验证CO2的密度比空气大之外,还能说明CO2 具有__________性质。 |
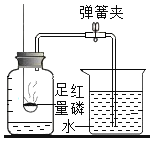
B 探究空气 中氧气含量 |
| 红磷燃烧的作用是 ______。 |
C 证明水的组成 |
| 该 反应的化学方程式 _____ |
D 检验NaCl中混有Na2CO3 |
| ①加入少量样品;②加入适量水至全部溶解;③加入____有气泡产生。 |
【题目】某课外兴趣小组为了测定当地石灰石中CaCO3的质量分数,取25g石灰石样品,粉碎后,将100g一定质量分数的稀盐酸分5次加入到该样品中,所测数据如下表所示(杂质不与稀盐酸反应,也不溶于水):
次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
产生气体的质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
(1)第____次恰好完全反应;
(2)实验中所用稀盐酸的溶质质量分数是多少?