题目内容
【题目】根据下图,回答下列问题:
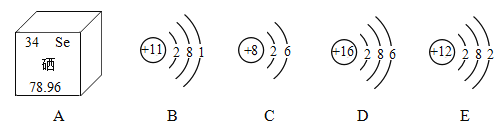
(1)图A所示中硒的相对原子质量是____;E在化学反应中容易____(填“得到”或“失去”)电子。
(2)与C的化学性质相似的粒子是________(填字母序号);
(3)B与C形成化合物的化学式为_________。
【答案】78.96 失去 D Na2O
【解析】
(1)元素周期表小方格元素名称下方数字表示相对原子质量,原子结构示意图中最外层电子数小于4时,原子易失电子,大于4时原子易得电子,故填:78.96;失去。
(2)最外层电子数相同的元素化学性质相似,C、D最外层电子数相同,故化学性质相似,故选:D。
(3)B为钠化合价+1价,C为氧元素化合价-2价,根据化合价代数和为零,化学式为Na2O,故填:Na2O。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】阅读下面的科普短文并完成相关问题。
洁厕灵:清洁用品,主要成分是盐酸,还有微量表面活性剂、香精等,能有效快捷消灭卫生间臭味、异味、清洁空气。对细菌繁殖体、芽胞、病毒、结核杆菌和真菌能有良好的杀灭作用。
84消毒液:是一种无色或者淡黄色具有刺激性气味的含氯液体消毒剂,被广泛的用于宾馆、医院、旅游、家庭等的卫生消毒。因其在1984年,被地坛医院的前身北京第一传染病医院研制出来,故被定名为“84消毒液”。它的主要成分是次氯酸钠,化学式为NaClO,其性质不稳定,光照条件下加速分解,一般84消毒液溶液pH为12左右,其杀菌作用主要依靠有效氯。某科研组对其0.5% 使用液中有效氯含量的稳定性进行了测定。 试验时 , 将有效氯含量为0.5%的使用液分别置于60oC、70oC、80oC、90oC 恒温水浴中, 放置过程中,按预定作用时间分别取样20ml置于容量瓶中,冷却至室温后, 用碘量法测定其有效氯含量,然后计算出各样品中有效氯的存留率(起始存活率为100%)。
附表:0.5% 84消毒液在不同温度、不同存放时间下的稳定性
作用时间 (小时) | 不同温度(oC)下有效氯存留率 | |||
60 | 70 | 80 | 90 | |
0(对照) | 100 | 100 | 100 | 100 |
1.5 | --- | --- | --- | 93.5 |
3.0 | --- | --- | 94.66 | 88.05 |
4.5 | --- | --- | --- | 81.37 |
6.0 | --- | 96.66 | 89.67 | 74.69 |
9.0 | --- | --- | 85.89 | --- |
10.0 | 97.02 | --- | --- | --- |
12.0 | --- | 93.32 | 82.62 | --- |
18.0 | --- | 91.56 | --- | --- |
20.0 | 94.75 | --- | --- | --- |
24.0 | --- | 89.46 | --- | --- |
30.0 | 92.99 | --- | --- | --- |
36.0 | --- | 82.95 | --- | --- |
40.0 | 91.07 | --- | --- | --- |
60.0 | 88.27 | --- | --- | --- |
依据文章内容回答下列问题。
(1)把少量洁厕灵喷到紫色小纸花上(用石蕊试液浸泡后晾干),观察到的现象是_____。
(2)次氯酸钠(NaClO)中氯元素的化合价是_______。
(3)下列说法正确的是_______
A 洁厕灵不宜用于清洗大理石器材及铝制品
B 一般84消毒液显酸性
C 84消毒液不宜长期存放
D 84消毒液应存放在阴暗、低温处,密封保存
(4)洁厕灵和84消毒液不能混用,否则产生有毒的氯气和另两种常见的化合物。其反应方程式为_________________。
(5)综合分析表中数据,在其他条件不变时,0.5% 84消毒液有效氯存留率受温度、时间影响,影响的变化趋势是___________________。
【题目】医用双氧水可杀灭肠道致病菌、化脓性球菌,一般用于物体表面消毒。小明同学腿部擦伤,大夫在她伤口上涂了医用过氧化氢溶液,小明看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
(查阅资料)
(1)过氧化氢是人体代谢废物之一,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(实验探究)
小明准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水,并用排水法。记录2分钟收集的气体体积。
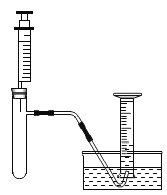
进行实验:
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | (1)__________ |
② | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次向试管中加入一小粒过氧化氢酶,然后浸在37℃的温水中 (2)第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解速率加快是因为过氧化氢酶的作用 |
(3)实验①②中,有三次收集到的气体均为5 mL,若用带火星的木条去检验这5 mL气体,观察到现象是________________。
(4)写出过氧化氢在过氧化氢酶的作用下分解的化学方程式:__________________。
(实验反思)
小明反思了实验过程,认为实验①得出的结论可能存在不足。于是他又查阅资料。科研工作者以10 mL30%的H2O2溶液为样本,加入相同的过氧化氢酶,分别做了如下9组不同的实验,所得如下数据:
序号 | 因素 | O2(ml) | ||
温度 | pH | 浸取时间 | ||
1 | 35 | 6.4 | 6 | 43.7 |
2 | 35 | 6.8 | 8 | 71.6 |
3 | 35 | 7.2 | 10 | 38.4 |
4 | 37 | 6.4 | 6 | 52.3 |
5 | 37 | 6.8 | 8 | 97.6 |
6 | 37 | 7.2 | 10 | 41.2 |
7 | 39 | 6.4 | 6 | 47.4 |
8 | 39 | 6.8 | 8 | 77.4 |
9 | 39 | 7.2 | 10 | 37.7 |
(5)综合分析表中数据,本实验最适宜条件为____组(填序号),影响过氧化氢酶发挥作用的因素有_________。酶对双氧水分解的催化作用受多个因素影响,不仅各个因素独立作用,而且因素之间有联合作用,有时个别因素对酶的抑制较强。
【题目】某校化学兴趣小组同学利用数字化传感器探究稀盐酸和氢氧化钠的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。

(1)根据图示可知:该实验是用胶头滴管逐滴将______(填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中至过量,反应的化学方程式为________。
(2)在b点时,溶液中溶质的化学式为_________。
(3)在实验过程中,同学们发现溶液中有少量气泡产生。
(提出问题)为什么会有气泡产生?
(作出猜想)甲同学认为氢氧化钠溶液已经变质,乙同学认为氢氧化钠溶液没有变质。你认为乙同学作出这种猜测的理由是_________。
(设计实验)为确定氢氧化钠溶液是否变质,同学们设计如下实验方案:
操作步骤 | 实验现象 | 实验结论 |
①取少量氢氧化钠溶液样品于试管中,加入过量的_____溶液,振荡,静置 | 有白色沉淀生成 | 氢氧化钠溶液 部分变质 |
②取①中上层清液,加入无色酚酞溶液 | ______ |
(交流反思)氢氧化钠暴露在空气中容易变质,故应_______保存。
【题目】某化学兴趣小组发现了一包敞口放置的碱石灰样品,为探究其成分,同学们在实验室对这包碱石灰样品展开了探究。
[查阅资料]①碱石灰是由CaO和NaOH固体混合而成,通常用于吸收二氧化碳及干燥气体。
②熟石灰微溶于水,且溶于水放出的热量很少可以忽略不计。
③CaC12溶液显中性。
(1)[提出猜想]根据资料,同学们分析该碱石灰样品的主要成分可能含有CaO、NaOH、Na2CO3、CaCO3和_____。
(2)[实验探究]小组同学讨论后设计如下实验进行探究:
实验步骤及操作 | 实验现象 | 结论 |
①取部分该样品于试管中,加少量水 | 无明显放热现象 | 石灰样品中不含CaO和_____ |
②继续加足量水,震荡,静置 | 出现白色沉淀 | 样品中一定含有CaCO3 |
③从步骤②的试管中取少量上层清液于另一试管中,向其中滴加过量CaCl2溶液 | 产生白色沉淀 | |
④将步骤③所得物质过滤,向滤液中滴加无色酚酞试液 | 溶液变红色 |
(3)[思考与分析]小宇同学经过分析认为步骤②的结论不正确,原因是_____(用化学方程式表示)。
(4)[解释与结论]通过以上探究与分析可以得出碱石灰样品一定含有的物质是_____;可能含有的物质是_____。实验探究步骤④所得溶液中除酚酞外,还含有的溶质有_____。


