题目内容
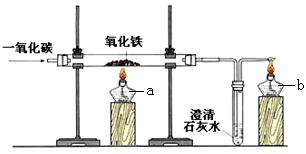
将CO气体通入2g氧化铜和铜的混合物中,加热到质量不再发生变化时称得残余物为1.68g,求混合物中氧化铜的质量分数。
80%
试题分析:依题意,发生化学反应:CO+ CuO 加热 Cu + CO2,解法1:据此反应,可分析出反应前后固体质量的减少其实就是氧化铜中的氧元素质量,可算出氧化铜中的氧元素质量=2g-1.68g=0.32g,在根据CuO中CuO与O的质量关系=80:16,即可求出氧化铜的质量
解:设氧化铜的质量为x
80:16=x:0.32g
x=1.6g
氧化铜的质量分数=1.6g/2g×100%=80%
解法2:根据质量差,根据化学方程式CO + CuO =" Cu" + CO2 ,固体质量差80-64=16,这个固体质量差可以与化学方程式里的任何一种物质形成质量关系,即
CO + CuO =" Cu" + CO2 △m
28 80 64 44 16
可以这样理解要形成16g的固体质量差,那么就一定有16g的一氧化碳和80g的氧化铜发生反应,同时生成64g的铜和44g的二氧化碳,进而可以根据这个质量关系,算出氧化铜的质量

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目