题目内容
实验室常用大理石与稀盐酸反应来制取二氧化碳,现用25g含碳酸钙为80%的大理石与200g稀盐酸反应制取二氧化碳,恰好完全反应。试计算:
(1)生成二氧化碳的质量是多少?(2)所用稀盐酸的溶质质量分数是多少?
(3)反应后所得溶液的质量分数是多少?(计算结果精确到0.1%)
(1)生成二氧化碳的质量是多少?(2)所用稀盐酸的溶质质量分数是多少?
(3)反应后所得溶液的质量分数是多少?(计算结果精确到0.1%)
(1)8.8g (2)7.3% (3)10.5%
试题分析:设生成二氧化碳的质量为X,所用盐酸的溶质的质量分数为Y,生成的氯化钙的质量为Z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
25g×80% Y×200g Z x
100:44="25g×80%" :X 100:111=25g×80%:Z 100:73=25g×80%:Y×200g
X=8.8g; Z= 22.2g Y=7.3%
所的溶液的质量分数为:
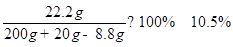
答:生成二氧化碳的质量为8.8g,所用盐酸的溶质的质量分数为7.3%;反应后所得溶液的质量分数是10.5%

练习册系列答案
相关题目
 3X+4H2O为动力来源.
3X+4H2O为动力来源.