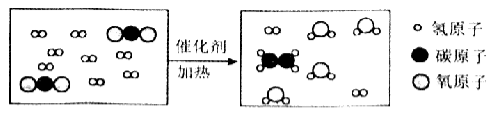
��Ŀ����
����Ŀ�������Ǽ�ͥ�����г���ʳ�ij��ѧ��ȤС��ͬѧ�Լ������е�CO32������CaCO3����ʽ���ڣ���CaCO3������������������̽����
I�����Է���
��ʵ��Ŀ�ģ���֤����������CO32��
��ʵ�鷽����
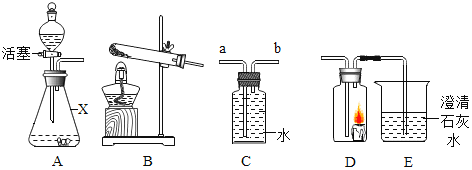
��ͼ1��ʾ��
��ʵ����ۣ�����������CO32��
��1����������ʵ����ۣ�������м���Ĺ���ϡ��Ӧ����_____��ѡ����ϡ����������ϡ����������
��2����������ϡ�ᷴӦ���ɵ���ɫ��ζ��������_____��д��ѧʽ����
��3��д������������ɰ�ɫ�����Ļ�ѧ��Ӧ����ʽ_____��
��������
��ʵ��Ŀ�ģ��ⶨ��������CaCO3������������
Ϊ�˲ⶨ��������CaCO3������������ͬѧ��ͨ���������ۺ���������·�����
ȡag��Ʒ������CaCO3��ϡ�ᷴӦ����CO2��ͨ���ⶨ����CO2��������������Ʒ��CaCO3������������
���������ϣ���ʯ��������ˮ�ֺͶ�����̼��Ũ����������ˮ�֣����������������
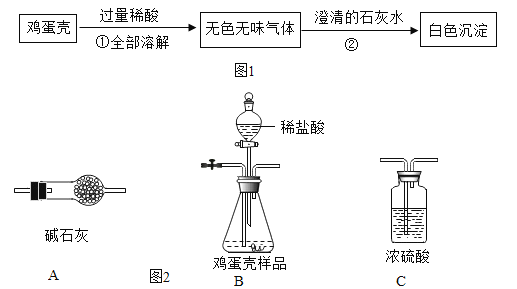
��ʵ����̣���ѧ��ȤС���ͬѧ����ͼ2װ������˱�ʵ�顣
��4��ʵ��ǰ����Ҫ��Bװ����ͨ�뵪������Ϊ���ž�Bװ���е�_____��
��5��ʵ��װ�õ���ȷ����˳����_____������ţ���
��B��A��C��A
��B��C��A��A
��A��B��C��A
��6��Bװ���еķ�Ӧ��ȫ�������ٴ�ͨ�뵪��������ͨ�뵪�����ᵼ�¼�������CaCO3�����������IJⶨ���_____��ѡ����ƫ��������ƫС����������������
���𰸡�ϡ���� CO2 Ca��OH��2+CO2��CaCO3��+H2O ���� �� ƫС
��������
��1������̼��ƺ����ᷴӦ��������ˮ������ƣ������ڴ���ʯ���棬�谭�ķ�Ӧ�ļ������н��з�����
��2������̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���з�����
��3�����ݶ�����̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ���з�����
��4�����ݿ����еĶ�����̼Ҳ�����ʯ�ҷ�Ӧ���з�����
��5�����ݼ�ʯ��������ˮ�ֺͶ�����̼��Ũ����������ˮ�ֽ��з�����
��6�����ݲ�ͨ�뵪����װ���еĶ�����̼���ܱ���ʯ�����գ����ӵ������ͻ��С���з�����
��1��̼��ƺ����ᷴӦ��������ˮ������ƣ������ڴ���ʯ���棬�谭�ķ�Ӧ�ļ������У����Բ�����м���Ĺ���ϡ��Ӧ����ϡ���
��2��̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼�����Է�Ӧ���ɵ���ɫ��ζ��������CO2��
��3��������̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ����ѧ����ʽΪ��Ca��OH��2+CO2��CaCO3��+H2O��
��4�������еĶ�����̼Ҳ�����ʯ�ҷ�Ӧ������ʵ��ǰ����Ҫ��Bװ����ͨ�뵪������Ϊ���ž�Bװ���еĿ�����
��5����ʯ��������ˮ�ֺͶ�����̼��Ũ����������ˮ�֣�����ʵ��װ�õ���ȷ����˳����B��C��A��A��
��6����ͨ�뵪����װ���еĶ�����̼���ܱ���ʯ�����գ����ӵ������ͻ��С���ᵼ�¼�������CaCO3�����������IJⶨ���ƫС��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʵ����ʵ�Ľ�����ȷ���ǣ�������
ѡ�� | ʵ����ʵ | ���� |
A | �ƾ���Һ���ܵ��� | ��Һ��û�������ƶ������� |
B | ����ȼ������ | �����к���C��H��OԪ�� |
C | ˮ����Ϊˮ��������ռ������ | ���Ӽ����� |
D | ���ʯ��ʯī���������ʲ���ϴ� | �������ǵ������ͬ |
A. A B. B C. C D. D