题目内容
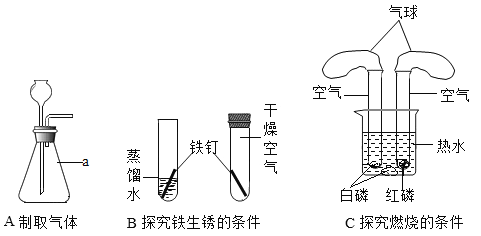
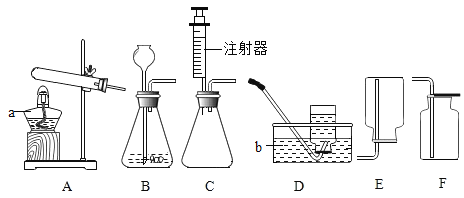
【题目】某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备 实验。

(1)写出仪器名称:①______________________________。
(2)甲同学用高锰酸钾制取氧气,选用的发生装置是_____(填字母),反应的化学方程式为_____________________,为防止实验中高锰酸钾进入导管,应采取的措施是___________________。若用 E 装置收集的氧气,在完成硫粉在氧气中燃烧的实验时,集气瓶内要预留适量的水(图 F 所示),水的作用是_____________________。
(3)实验室可用锌粒和稀盐酸在常温下制取氢气,应选择的发生装置是(填字母,下同)___________________,收集纯净的氢气最好选择装置___________________,用该装置收集氢气的收集方法叫___________________,用该方法收集的氢气 若不纯,其原因可能是___________________。
(4)丙同学称取一定质量的 KMnO4固体放入大试管中,将温度控制在 250℃加热制取 O2。实验结束时,乙同 学发现用排水法收集到的 O2 大于理论产量。针对这一现象,同学们进行了如下探究:
(提出猜想)
猜想Ⅰ:反应生成的 MnO2 分解出 O2;
猜想Ⅱ:反应生成的 K2MnO4 分解放出 O2;
猜想Ⅲ:反应生成的 K2MnO4 和 MnO2分解都放出 O2。
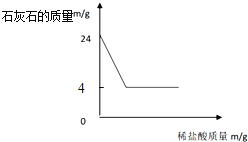
(实验验证) 同学们分为两组,分别进行下列实验:第一组同学取一定质量的 MnO2,在 250℃条件下加热一段时间,冷却后,测得 MnO2 的质量不变,则猜想_____错误;第二组同学取K2MnO4在 250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论。该组同学选择的实验方法是_______________________。
(拓展延伸)
实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KClO3固体与 KMnO4固体混合加热,则KClO3的分解速率大大加快。请说明 KMnO4在 KClO3 的分解反应中是否作催化剂,为什么?________________。
【答案】水槽 A 2KMnO4![]() K2MnO4 + MnO2+O2↑ 在试管口放一团棉花 吸收 SO2,防止污染空气 B E 排水法 未等气泡连续均匀冒出时即开始收集 Ⅰ和Ⅲ 将带火星的木条放入试管内 高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因 为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用
K2MnO4 + MnO2+O2↑ 在试管口放一团棉花 吸收 SO2,防止污染空气 B E 排水法 未等气泡连续均匀冒出时即开始收集 Ⅰ和Ⅲ 将带火星的木条放入试管内 高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因 为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用
【解析】
(1)仪器①是水槽;故填:水槽。
(2)高锰酸钾制取氧气属于固固加热型,故选A;实验室加热高锰酸钾生成锰酸钾和二氧化锰和氧气,反应原理用化学方程式表示为:2KMnO4![]() K2MnO4+MnO2+O2↑;防止高锰酸钾粉末进入导管,应采取的措施是试管口放一团棉花;若用 E 装置收集的氧气,在完成硫粉在氧气中燃烧的实验时,集气瓶内要预留适量的水(图 F 所示),水的作用是吸收生成的二氧化硫,防止污染空气。
K2MnO4+MnO2+O2↑;防止高锰酸钾粉末进入导管,应采取的措施是试管口放一团棉花;若用 E 装置收集的氧气,在完成硫粉在氧气中燃烧的实验时,集气瓶内要预留适量的水(图 F 所示),水的作用是吸收生成的二氧化硫,防止污染空气。
故填:A; 2KMnO4![]() K2MnO4 + MnO2+O2↑;在试管口放一团棉花;吸收 SO2,防止污染空气。
K2MnO4 + MnO2+O2↑;在试管口放一团棉花;吸收 SO2,防止污染空气。
(3)锌粒和稀硫酸反应是硫酸锌和氢气,发生装置的特点属于固液常温的反应,故选择B装置;收集氢气可以采用向下排空气法或排水法,但排水法收集的氢气较纯净;用该方法收集的氢气 若不纯,其原因可能是未等气泡连续均匀冒出时即开始收集。
故填:B;E;排水法;未等气泡连续均匀冒出时即开始收集。
(4)[实验验证]同学们分为两组,分别进行下列实验:第一组同学取一定质量的 MnO2,在 250℃条件下加热一段时间,冷却后,测得 MnO2 的质量不变,则猜想Ⅰ和Ⅲ错误;第二组同学取K2MnO4在 250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论。该组同学选择的实验方法是将带火星的木条放入试管内,带火星的木条复燃。
故填:Ⅰ和Ⅲ;将带火星的木条放入试管内。
[拓展延伸]
实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KClO3固体与 KMnO4固体混合加热,则KClO3的分解速率大大加快。高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因 为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用。
故填:高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因 为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
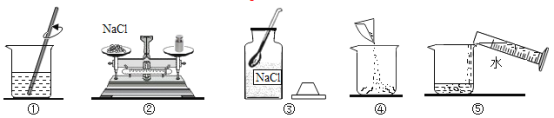
金牌教辅培优优选卷期末冲刺100分系列答案【题目】胶头滴管内有某液体X,集气瓶内为某物质Y,现捏胶头将X挤入集气瓶内,能使气球变大的是:
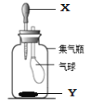
① | ② | ③ | ④ | |
X | 稀硫酸 | H2O | 石灰水 | 稀盐酸 |
Y | Zn | NH4NO3 | 干冰 | CaCO3 |
A. ①② B. ③④ C. ②③ D. ①④
【题目】酒精灯是实验室中常用加热仪器,某兴趣小组同学对酒精灯进行如下探究。
(Ⅰ)定性研究甲同学取一根火柴梗,拿住一端迅速平放入酒精灯火焰中,1~2s后取出,观察到位于焰心的部分没有明显变化,说明焰心温度最低。
(1)写出碳完全燃烧的文字表达式(或符号表达式)__________。
(Ⅱ)定量研究
乙同学用注射器抽取灯芯和焰心交界处气体,利用氧气传感器测量氧气的体积分数(见下表),丙同学利用高温传感器测定酒精灯灯芯和焰心交界处温度(见下表)。
测量次数 | 第一次 | 第二次 | 第三次 |
灯芯和焰心交界处 氧气体积分数 | 5.93% | 5.29% | 6.53% |
灯芯和焰心交界处温度/℃ | 236 | 243 | 240 |
(2)乙、丙同学多次进行测量的目的是_____。
(3)火柴梗燃烧需要氧气的最低含量是14.0%,着火点是270℃,结合上表谈谈你对“火柴梗在焰心处没有明显变化”的认识_____。
(4)如果考虑抽气时空气的影响,则乙同学测出的氧气浓度比焰心的实际氧气浓度_____。(填“高”或“低”):另外乙同学所测氧气的体积分数差异的原因可能是①_____;②_____。