题目内容
【题目】将146g稀盐酸慢慢加入到24g含有杂质的石灰石(杂质不溶于水也不与酸反应)中,反应情况如图所示.完成以下计算:
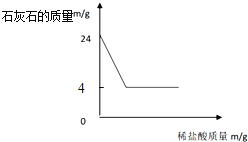
(1)石灰石样品中碳酸钙的质量为_________克?
(2)求该稀盐酸的溶质质量分数________。
(3)反应后所得溶液溶质质量分数________。
【答案】20 10% 14.1%
【解析】
(1)由图象知,最后剩余4g为杂质的质量,则碳酸钙的质量为:24g-4g=20g;
设生成二氧化碳的质量为x,盐酸中溶质的质量为y,生成的氯化钙的质量为z;
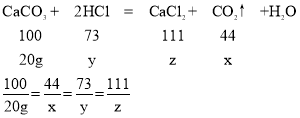
解得:x=8.8g,y=14.6g,z=22.2g
(2)该稀盐酸的溶质质量分数:![]() ×100%=10%;
×100%=10%;
答:该稀盐酸的溶质质量分数为10%。
(3)反应后所得溶液溶质质量分数为![]() ;
;
答:反应后所得溶液溶质质量分数14.1%。

练习册系列答案
相关题目