题目内容
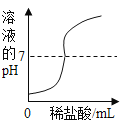
【题目】(1)在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:
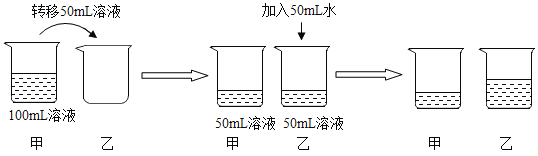
a.最终甲、乙两烧杯中溶液一定是饱和溶液的是_____。
b.乙溶液在加50mL水的过程中,下列这些量逐渐减小的是_____。
①溶解度 ②溶质质量分数 ③溶剂的质量 ④溶液的密度
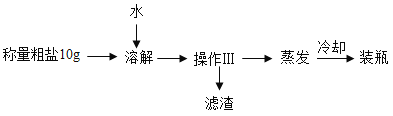
(2)提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
温度(℃) | 溶解度(g) |
20 | 36.0 |
40 | 36.6 |
60 | 37.3 |
①20℃时氯化钠的溶解度是_____
②该实验是利用泥沙难溶于水而氯化钠_____的性质进行提纯,操作Ⅲ的名称是_____。
③关于蒸发叙述正确的是_____(选填编号)。
a、蒸发是通过加热的方法将水汽化除去
b、所需仪器为酒精灯、蒸发皿、温度计
c、搅拌可以防止蒸发过程中液滴飞溅
d、加热过程中用试管夹夹住蒸发皿移动,使其均匀受热
④溶解时,加入水的合适的量约为_____(选填“15”、“30” 或“60”)mL。
【答案】甲 ②④ 36.0g/100g水 易溶于水 过滤 ac 30
【解析】
(1)a.由图所示操作可知,最终甲烧杯中的溶液为原溶液是饱和溶液,乙烧杯中的溶液加入了水是不饱和溶液。故填:甲。
b.由图所示操作可知,最终甲、乙两烧杯中溶液中溶质质量相同,溶质质量分数不同即甲大乙小,溶剂的质量不同即甲小乙大,温度不变的情况下,溶解度不变,氯化钠密度比水的密度大,溶质质量分数变小,密度变小。故选②④。
(2)①20℃时氯化钠的溶解度是36.0g/100g水;
②该实验是利用泥沙难溶于水而氯化钠易溶于水的性质进行提纯,操作Ⅲ的名称是过滤;
③a、蒸发是通过加热的方法将水汽化除去,故正确;
b、所需仪器为酒精灯、蒸发皿、玻璃棒,故错误;
c、搅拌可以防止蒸发过程中食盐水飞溅,故正确;
d、加热过程中不能用试管夹夹住蒸发皿移动,使其均匀受热,故错误。
故选:ac;
④溶解时,加入水的合适的量约为30mL,理由是:20℃时,氯化钠的溶解度为36g/100g水,实验中称取的粗盐质量为10g,加入约30mL水既可使粗盐中的氯化钠充分溶解,又不会因加水过多而影响后续蒸发操作的效率。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】下列图像不能正确反映其对应操作的是
A | B | C | D |
|
|
|
|
在一定量的AgNO3溶液中逐滴加入NaCl溶液 | 等质量Zn和Mg分别与足量的等浓度稀硫酸反应 | 向NaOH溶液中逐滴加入稀盐酸 | 等质量CaCO3分别与足量的等浓度稀盐酸反应 |
A. A B. B C. C D. D
【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
探究活动一:认识工具
如下图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| 乙 | 丙 | |||
| 甲 | 丁 | 戊 |
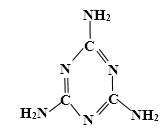
(1)认识符号:NO3-名称是________;
(2)写化学式:丙物质的化学式是________;
(3)物质分类:五种物质中,属于碱的是________(用化学式表示);
(4)溶解能力:五种物质中,只有一种不溶于水,它是________(用化学式表示)。
探究活动二:运用工具
有一包白色粉末可能含有氯化钡、碳酸钡、碳酸钠、氢氧化钠和硫酸钠中的一种或几种,取一定量该粉末样品加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物,小郑同学将烧杯中的物质过滤,得滤渣A和滤液B,取滤渣A于试管中滴加过量稀硝酸,观察到滤渣全部溶解,有气泡产生。
小杨同学进一步设计了如下实验方案,确定白色粉末的组成:

针对上述实验方案中各步骤的现象,小杨同学提出下列三种不同的假设,依据每种假设中各步骤不同的实验现象,可得出不同的实验结论。
步骤一 | 步骤二 | 步骤三 | |
假设一 | 有白色沉淀生成 | ||
无白色沉淀生成 | 溶液变红 | 溶液变为无色 | |
假设三 | 无白色沉淀生成 | 无明显现象 | 无明显现象 |
(1)依据假设一的现象,可确定原白色粉末中只含有碳酸钡、碳酸钠、氢氧化钠和硫酸钠四种物质。则步骤二的现象是________;步骤三中发生的任意一个化学反应的化学方程式是________。
(2)依据假设二的现象,原白色粉末可能的组成是________。(任写一种可能的组成,用化学式表示);
(3)依据假设三的现象,原白色粉末可能的组成有________种。