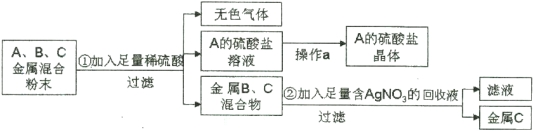
题目内容
【题目】工业炼铁是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来.计算:
(1)Fe2O3的相对分子质量是_____;
(2)1000t含氧化铁80%的赤铁矿中,其氧化铁的质量是_____t;
(3)上述赤铁矿理论上可炼得含铁96%的生铁_____t。
【答案】160 800 583.3
【解析】
解:(1)Fe2O3的相对分子质量是56×2+16×3=160。
(2)1000t含氧化铁80%的赤铁矿中,其氧化铁的质量是1000t×80%=800t。
(3)设理论上可炼出含铁98%的生铁质量为x.

![]()
解得: x≈583.3t
答:(1)Fe2O3的相对分子质量是160;
(2)1000t含氧化铁80%的赤铁矿中,其氧化铁的质量是800t;
(3)上述赤铁矿理论上可炼得含铁96%的生铁583.3。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目