题目内容
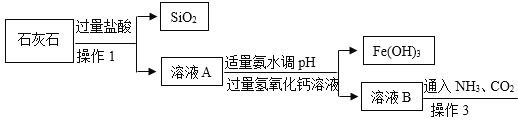
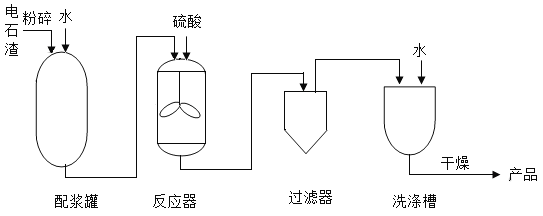
【题目】以MnO2为原料制备MnSO4H2O的工业流程如图。
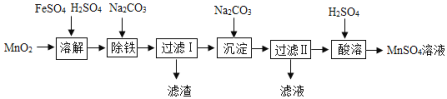
已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO36Mn(OH)25H2O↓+7Na2SO4+6CO2↑
②MnSO4H2O和MnSO45H2O易溶于水,难溶于乙醇。
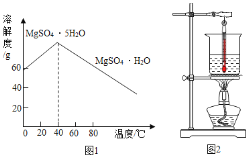
③MnSO4的溶解度曲线如图1所示。
(1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、① _____、_____。水浴加热的优点有②_____________。能加快溶解的方法有③_________(写一种)。
(2)除铁时需要搅拌,搅拌的作用是____________。
(3)过滤I所得滤液的溶质主要是Na2SO4和____________。
(4)酸溶时,MnCO36Mn(OH)25H2O与足量稀硫酸反应的化学方程式为___________________。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4H2O的实验方案:将MnSO4溶液转移至蒸发皿中,___________,在高于40℃时趁热过滤,____________,100℃烘干得MnSO4H2O。
【答案】烧杯 温度计 温度易控,受热均匀 提高温度或搅拌 使反应更充分,除铁更彻底 MnSO4 ![]() 蒸发浓缩 用乙醇洗涤
蒸发浓缩 用乙醇洗涤
【解析】
(1)溶解时,为控制80℃,可用水浴加热,根据水浴加热图可知,水浴加热需要的玻璃仪器有酒精灯、烧杯、温度计;水浴加热的优点有温度易控,受热均匀;能加快溶解的方法有提高温度、搅拌等;
(2)除铁时需要搅拌,这样可使反应物之间充分接触,使反应更充分,除铁更彻底,所以搅拌的作用是使反应更充分,除铁更彻底;
(3)由于沉淀时发生的反应为![]()
故过滤I所得滤液对应的溶质一定含有 MnSO4;
(4)根据碳酸盐与酸反应和碱与酸反应的特点可知,酸溶时,MnCO36Mn(OH)25H2O与足量稀硫酸反应生成硫酸锰和水以及二氧化碳,对应的化学方程式为![]()
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4H2O的实验方案:将MnSO4溶液转移至蒸发皿中,蒸发浓缩,在高于40℃时趁热过滤,用乙醇洗涤(MnSO4H2O和MnSO45H2O易溶于水,难溶于乙醇,用乙醇洗涤一方面减少因为水溶解造成的损失,另外一方面乙醇易挥发,以便后期干燥除杂),100℃烘干得MnSO4H2O。

【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11g样品及足量的水配成溶液;②向三个烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到wg的白色固体.实验数据如下:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入CaCl2的质量/g | 5.55 | 12 | 15 |
W/g | 5 | 10 | 10 |
回答下列问题:
(1)将烧杯Ⅲ中的溶液蒸干,得到 g固体,该固体由 和 组成(只填化学式).
(2)样品中碳酸钠的质量分数是多少?
【题目】某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把100 g稀盐酸分5次加入,测量过程所得数据见下表(已知石灰石样品中杂质不溶于水,不与稀盐酸反应),各次稀盐酸用量和反应后剩余固体质量记录如下:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
实验后剩余固体的质量/g | 13 | 10 | 7 | 6 | m |
请回答:
(1)上表中m的数值为 。
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)在第5次实验后的溶液中,再加人足量的该石灰石样品粉末,完全反应后过滤,求所得溶液的溶质质量分数。(假设实验过程中溶液损失忽略不计)
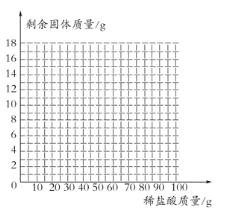
(4)画出16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图 (不用写出计算过程。)
(5)第一次加入20 g盐酸的反应速率为ν1,第二次加入20g盐酸的反应速率为ν2,则ν1 ν2(选填“>”“<”或“=”)。