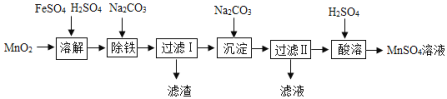
题目内容
【题目】某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把100 g稀盐酸分5次加入,测量过程所得数据见下表(已知石灰石样品中杂质不溶于水,不与稀盐酸反应),各次稀盐酸用量和反应后剩余固体质量记录如下:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
实验后剩余固体的质量/g | 13 | 10 | 7 | 6 | m |
请回答:
(1)上表中m的数值为 。
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)在第5次实验后的溶液中,再加人足量的该石灰石样品粉末,完全反应后过滤,求所得溶液的溶质质量分数。(假设实验过程中溶液损失忽略不计)
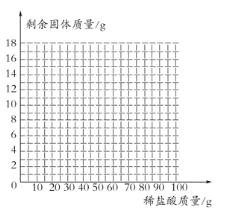
(4)画出16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图 (不用写出计算过程。)
(5)第一次加入20 g盐酸的反应速率为ν1,第二次加入20g盐酸的反应速率为ν2,则ν1 ν2(选填“>”“<”或“=”)。
【答案】(1)6;(2)62. 5%(3)15. 36%(4)如图
(5) >
【解析】
(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为3g,而第3次反应后固体物质减少的质量为1g,说明此时碳酸钙已反应完,固体质量不再改变,故表中m的数值为6。
(2)石灰石样品中杂质不溶于水,不与稀盐酸反应,故反应中减少的固体质量即碳酸钙质量,反应中石灰石样品中碳酸钙的质量分数为![]() 。
。
(3)根据题干中数据,设盐酸的质量分数为x,按盐酸全部反应的数据即可计算,根据第1次消耗的碳酸钙的质量16g-13g=3g计算

![]()
解得x=10.95%
设第5次实验后,再加人足量的该石灰石样品粉末,此时100g盐酸完全反应,设生成氯化钙的质量为y,生成二氧化碳的质量为z,参加反应的碳酸钙的质量为m,

![]()
![]()
![]()
解得y=16.65g,z=6.6g,m=15g
反应后氯化钙的质量分数为:![]()
(4)根据表格中信息知,每20克该浓度的盐酸与3克碳酸钙恰好反应,16g样品中碳酸钙的质量是10g,消耗盐酸的质量为:![]() ,16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图如下:
,16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图如下:

![]()
(5)固体反应物的状态、溶液的浓度,反应的温度等都会影响反应速率,第一次加入20 g盐酸的反应速率为ν1,反应消耗掉氯化氢,剩余水,第二次加入20g盐酸,加入盐酸后的浓度小于第一次加入盐酸的浓度,故反应速率为ν1>ν2。

【题目】为了测定某钢中铁的质量分数,某同学进行了下列实验:取10.0g粉碎的钢样品放入烧杯中,将122.5g稀硫酸分5次加入该烧杯中,充分反应后(假设杂质不溶于水,也不与酸反应) ,测得剩余固体的质量数据记录如下:
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀硫酸的质量/g | 24.5 | 24.5 | 24.5 | 24.5 | 24.5 |
剩余固体的质量/g | 7.9 | 5.8 | 3.7 | a | 0.2 |
请计算:
(1)H2SO4中硫、氧元素的质量比为 (填最简整数比)。
(2)表格中a的值为 。
(3)该钢样品中铁的质量分数为 。
(4)所加稀硫酸的溶质质量分数。