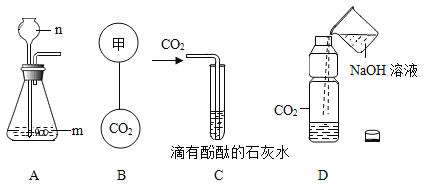
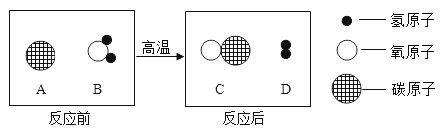
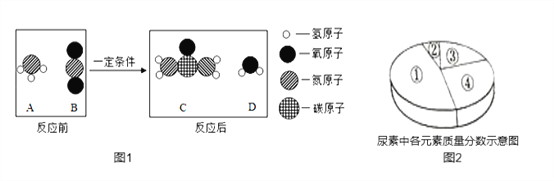
题目内容
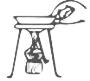
【题目】某种镀锡铜线表面锡的褪除及回收的工艺流程如图所示,请回答以下问题:
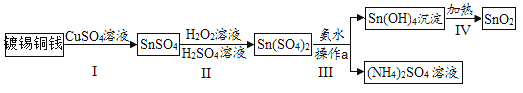
(1)Sn(OH)4中锡(Sn)的化合价为_________________。
(2)步骤Ⅲ中操作a的名称是_____________,该操作中用到的一种玻璃仪器的名称是______________。
(3)写出过程I中发生反应的化学方程式:_____________;过程IV发生的反应的基本反应类型是________。
【答案】+4 过滤 漏斗(或烧杯、玻璃棒) ![]() 分解反应
分解反应
【解析】
(1)氢氧根离子通常为-1价,设Sn(OH)4中锡元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:x+(-1)×4=0,x=+4;
(2)操作a实现了固液分离,故操作a是过滤;
过滤操作中用到的玻璃仪器有:烧杯、漏斗、玻璃棒;
(3)在金属活动性顺序里,Sn位于铜之前,Sn能与硫酸铜反应生成SnSO4和铜,该反应的化学方程式为:![]() ;
;
由图可知,过程IV为Sn(OH)2在加热的条件下反应生成SnO2,根据质量守恒定律,化学反应前后,元素的种类不变,故还有水生成,故该反应符合“一变多”的特点,属于分解反应。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
(1)[实验一]
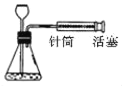
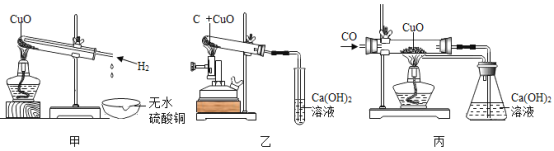
利用下图实验装置(夹持和加热装置省略) , 在HCl气流中小心加热MgCl2. 6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:![]() 。
。
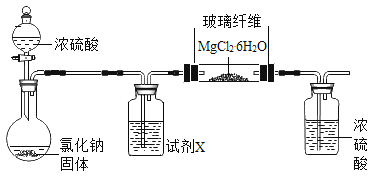
①试剂X是____。第二个洗气瓶中的浓硫酸的作用是_____。
②该实验装置存在一个缺陷是___。
(2)[实验二]
通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
称取m1 g样品置于烧杯中,充分溶解;加入足量硝酸银溶液,充分反应后,过滤;洗涤沉淀,干燥至恒重,称得沉淀质量为m2 g。
①若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量___ ( 填“偏高”或“偏低”)。
②若测得m1=10.40,m2=28.70,则所得产品MgCl2.nH2O中n的值为___。
(3)[实验三]
一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
实验序号 | 氯化镁固体中氯元素含量/% | 温度/°C | 粉碎方式 | 催化效果/g.g-1 |
1 | 70.97 | 20 | 滚动球磨 |
|
2 | 74.45 | 20 | 滚动球磨 |
|
3 | 74.45 | 20 | 振动球磨 |
|
4 | ω | 100 | 振动球磨 |
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
①表中ω=_____。
②从实验1、2可以得出的结论是_______。
③设计实验2、3的目的是___。