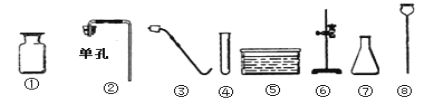
题目内容
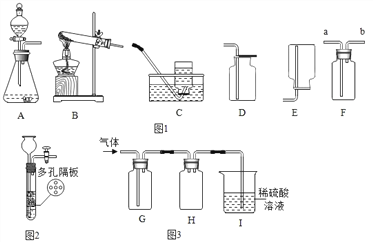
【题目】如图装置常用来完成气体制备及性质实验,试回答下列问题:
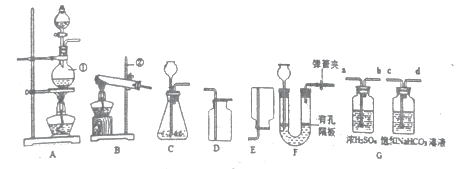
(1)标号①②的仪器名称:①________②______
(2)实验室选用B、D装置制取O2,则发成反应的化学方程式为_________
(3)选择发生装置C和收集装置________(选填序号)常用于实验室制取CO2,若将发生装置由C改为F,其优点是____________。
①为了得到纯净干燥的CO2气体,图G除杂装置的导管气流方向连接顺序是______________(填选项)
A.a-b-c-d B.b-a-c-d C.c-d-a-b D.d-c-b-a
②用化学反应方程式表示饱和碳酸氢钠溶液的作用_______________
实验时常用饱和的硫酸铵溶液和亚硝酸钠(NaNO2)溶液混合加热制取N2可选择图中发生装置________(填序号);反应装置加热片刻后可以移去酒精灯,反应依旧进行,说明反应为______________反应(填“放热”或“吸热”);请将该反应的化学方程式补充完整:2NaNO2+(NH4)2SO4![]() 2N2
2N2![]() +NaSO4+________
+NaSO4+________
【答案】 烧瓶(圆底烧瓶) 铁架台 2KClO3![]() 2KCl+3O2
2KCl+3O2![]() D 可以控制反应的发生于停止 C NaHCO3+HCl=NaCl+H2O+CO2
D 可以控制反应的发生于停止 C NaHCO3+HCl=NaCl+H2O+CO2![]() A 放热 4H2O
A 放热 4H2O
【解析】本题主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的干燥和除杂等,综合性比较强。气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关。
(1)标号①②的仪器名称分别为:烧瓶(圆底烧瓶)、铁架台;
(2)实验室选用B、D装置制取O2,是用氯酸钾和二氧化锰加热生成氯化钾和氧气,反应的化学方程式为2KClO3![]() 2KCl+3O2
2KCl+3O2![]() ;
;
(3)二氧化碳密度比空气的密度大,能用向上排空气法收集,收集装置选D;F装置可通过弹簧夹的开和关,能控制固体和液体的接触和分离。若将发生装置由B改为F,其优点是:可控制反应的发生和停止;①为了得到纯净、干燥的CO2,要先除杂质再干燥,除杂装置的导管按气流方向连接顺序是c-d-a-b,故选C;②碳酸氢钠和盐酸反应生成氯化钠和水和二氧化碳反应的化学方程式是:NaHCO3+HCl=NaCl+H2O+CO2![]() ;实验时常用饱和的硫酸铵溶液和亚硝酸钠(NaNO2)溶液混合加热制取N2,反应物是固体和液体,反应需要加热,可选择图中发生装置A;反应装置加热片刻后可以移去酒精灯,反应依旧进行,说明反应为放热反应;根据质量守恒定律可知,元素种类、原子种类和个数在反应前后不变,可以判断出该反应的化学方程式还需补充4H2O,才算完整。
;实验时常用饱和的硫酸铵溶液和亚硝酸钠(NaNO2)溶液混合加热制取N2,反应物是固体和液体,反应需要加热,可选择图中发生装置A;反应装置加热片刻后可以移去酒精灯,反应依旧进行,说明反应为放热反应;根据质量守恒定律可知,元素种类、原子种类和个数在反应前后不变,可以判断出该反应的化学方程式还需补充4H2O,才算完整。

 名校课堂系列答案
名校课堂系列答案