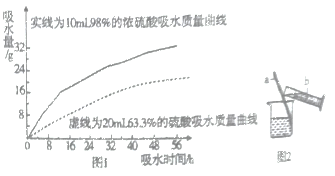
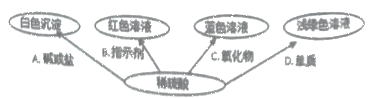
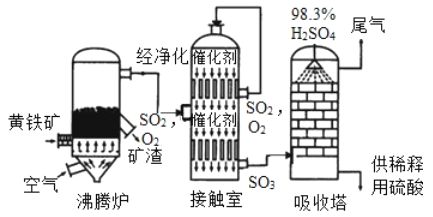
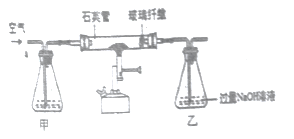
题目内容
【题目】根据所学知识填空:
(1)在“石墨、碳酸钙、盐酸、聚乙烯”中选择适当的物质填空。
①人体胃液中含有的酸是__________。 ②常用作电池电极的是:___________。
③可用作补钙剂的是______________。 ④可用作塑料大棚的是_____________。
(2)化学与人类生活、生产息息相关。
①从环境保护的角度考虑,理想的燃料是___________(填“氢气”或“煤”)。
②鱼、虾中富含____________(填“定粉”或“蛋白质”)。
③蔬菜、水果等是人体获取_____________(填营养素的名称)的主要食物来源。
(3)某金属原子的结构示意图为 ![]() ,则该原子的核电荷数为________;最外层电子数x=_____;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为________。
,则该原子的核电荷数为________;最外层电子数x=_____;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为________。
【答案】 盐酸 石墨 碳酸钙 聚乙烯 氢气 蛋白质 维生素 12 2 Mg2+
【解析】(1)①人体胃液中含有的酸是盐酸;②石墨具有导电性,常用作电池电极;③可用作补钙剂的是碳酸钙;④聚乙烯塑料可用作塑料大棚;(2)①从环境保护的角度考虑,理想的燃料是氢气,燃烧只生成水,不污染空气;②鱼、虾富含蛋白质;③蔬菜、水果等是人体获取维生素的主要食物来源;(3)据图可以看出,该原子的核电荷数为12,最外层电子数X=1228=2;若最外层电子失去则形成带2个单位正电荷的离子,Mg2+。

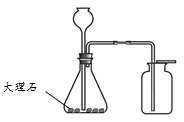
【题目】请从33-A或33-B两题中任选一个作答,若两题均作答,按33-A计分。
33-A | 33-B |
|
|
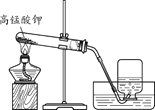
(1)实验室用高锰酸钾制取氧气的化学方程式为_____。 (2)证明收集到的气体为氧气的方法是_____。 | (1)用大理石和稀盐酸制取二氧化碳的化学方程式为_____。 (2)检验二氧化碳已经收集满的方法 是_____。 |