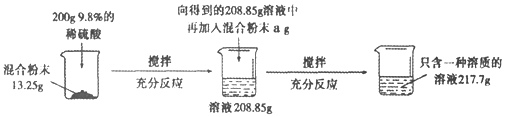
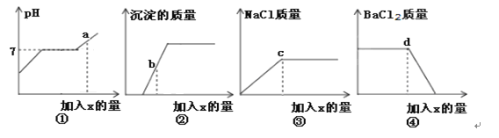
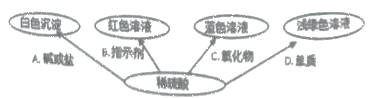
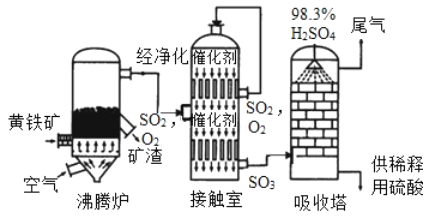
题目内容
【题目】为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
CaO
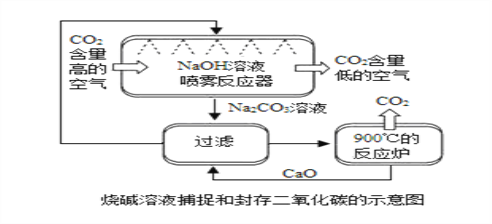
烧碱溶液捕捉和封存二氧化碳法(见上图):
①喷雾反应器中,发生反应的化学方程式为________,CO2+2NaOH═Na2CO3+H2ONaOH溶液喷成雾状的目的是 _________。
增大气体与液体的接触面积,使反应更充分
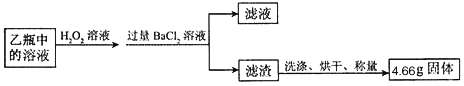
②过滤环节中所得滤渣的主要成分是 _____,CaCO3请用化学方程式说明原因:________,_______。
CaO+H2O═Ca(OH)2
③在整个流程中,循环利用的物质有 ____________________________。
【答案】 CO2+2NaOH═Na2CO3+H2O 增大接触面积充分吸收二氧化碳 CaCO3 CaO+H2O=Ca(OH)2 Ca(OH)2+Na2CO3= CaCO3↓+2NaOH NaOH、CaCO3 \CaO
【解析】根据题目给出的信息可知:在整个流程中,循环利用的物质是生石灰;烧碱溶液捕捉和封存二氧化碳法,即二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,化学方程式为:CO2+2NaOH═Na2CO3+H2O,NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分;因为生石灰和水反应生成熟石灰,熟石灰和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,因此过滤出的是碳酸钙白色沉淀;在整个流程中,循环利用的物质是生石灰和氢氧化钠溶液,化学方程式为:CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3= CaCO3↓+2NaOH;③在整个流程中,循环利用的物质有NaOH、CaCO3 \CaO。

 阅读快车系列答案
阅读快车系列答案【题目】某校实验室有一瓶保管不当的试剂,其残缺的标签中只剩下“钠”和“10%”字样,已知它是初中化学常用的试剂,小强和小华同学对这瓶试剂很感兴趣,决定对其成分进行探究:
(1)【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是_______ .
A. 酸 B. 碱 C. 盐
(2)【查阅资料】Ⅰ、初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3 .
Ⅱ、测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是________.
(3)【作出猜想】①可能是NaOH溶液;②可能是________溶液;③可能是NaCl溶液
(4)【设计并实验】
①小强取样品少量,滴加无色酚酞试液,液体变红色他认为猜想①正确,他的判断是不合理的,原因是________.
②小华为了检验该溶液到底是什么又进行了如下实验:取样品于试管中,滴加氯化钙溶液,有白色沉淀生成.猜想②正确.反应的化学方程式________.