题目内容
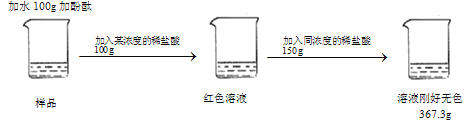
【题目】实验室有一瓶敞口放置的氢氧化钠固体(只含两种成分),某同学取样品23. 9g进行如图操作,(酚酞质量忽略不计)请回答下列问题。
(1)第一次加入稀盐酸时发生反应的方程式为_____。
(2)列出求解与稀盐酸反应生成气体的固体质量x的比例式_____。
(3)此样品中氢氧化钠的变质程度为_____。
(4)若将最终所得溶液的溶质质量分数变为10%, 则需要蒸发水的质量是_____。
(5)配置溶液时所用的玻璃仪器有烧杯、玻璃棒、_____、_____。
【答案】NaOH+HCl=NaCl+H2O ![]() 60% 74.8g 量筒 胶头滴管
60% 74.8g 量筒 胶头滴管
【解析】
(1)敞口放置的氢氧化钠固体(只含两种成分)中含有氢氧化钠和碳酸钠,加入盐酸先与氢氧化钠反应生成氯化钠和水,待氢氧化钠完全反应后再与碳酸钠反应生成氯化钠、水和二氧化碳。第一次加入稀盐酸时发生反应的方程式为:NaOH+HCl=NaCl+H2O;
(2)根据题意可知,反应生成的二氧化碳质量=23.9g+100g+100g+150g-367.3g=6.6g;
设生成6.6g的二氧化碳需碳酸钠的质量为x,生成氯化钠质量为y。
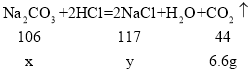
![]() x=15.9g;求解与稀盐酸反应生成气体的固体质量x的比例式:
x=15.9g;求解与稀盐酸反应生成气体的固体质量x的比例式:![]() ;
;
![]() y=17.55g;
y=17.55g;
(3)样品剩余氢氧化钠质量=23.9g-15.9g=8g;
设生成15.9g碳酸钠需要氢氧化钠的质量为a。
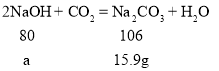
![]() a=12g;
a=12g;
此样品中氢氧化钠的变质程度=![]() ;
;
(4)设:8g氢氧化钠能生成氯化钠的质量为b。

![]() b=11.7g;
b=11.7g;
需要蒸发水的质量是为c;若将最终所得溶液的溶质质量分数变为10%,则有:
![]() c=74.8g;
c=74.8g;
则需要蒸发水的质量是74.8g;
(5)配置溶液时所用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管。

【题目】实验室某混合溶液由硫酸和硫酸铜溶液组成。探究小组同学进行了如下实验:取124.5g该混合溶液于烧杯中,然后将120gNaOH溶液分六次加入其中,每次充分反应后称量所得溶液及沉淀的质量,所测数据如下表所示。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
加入NaOH溶液的质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
反应后溶液的质量/g | 144.5 | 164.5 | 179.6 | 189.8 | 200 | 220 |
每次产生沉淀的质量/g | 0 | 0 | m | n | 9.8 | 0 |
计算:(1)上述表格中产生沉淀的质量:m=_____,n=_____
(2)所加NaOH溶液中溶质的质量分数。_____
(3)第5次加入NaOH溶液充分反应后所得溶液中溶质的质量分数。_____