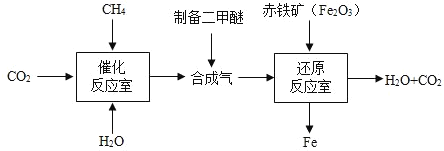
题目内容
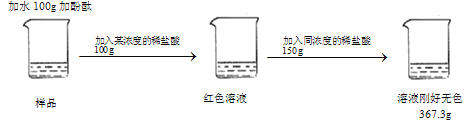
【题目】某化学小组在实验室中完成了以下实验,已知溶液甲无色。
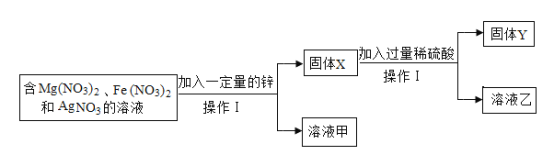
(1)X中一定含有的金属是_____。
(2)请写出加入稀硫酸一定发生反应的化学方程式_____。
(3)某同学猜想溶液甲的溶质有硝酸银、硝酸镁和硝酸锌,请分析该猜想错误的原因_____。
【答案】铁和银(或Fe和Ag) ![]() 溶液甲无色,溶液中无Fe(NO3)2,则一定没有AgNO3,因为Zn先与AgNO3反应,后与Fe(NO3)2反应
溶液甲无色,溶液中无Fe(NO3)2,则一定没有AgNO3,因为Zn先与AgNO3反应,后与Fe(NO3)2反应
【解析】
在金属活动性顺序中,排在氢前面的金属能与盐酸或稀硫酸发生置换反应,排在前面的金属能把排在后面的金属从它们的化合物溶液中置换出来。镁、铁、银、锌、氢的活动性由强到弱的顺序为Mg>Zn>Fe>H>Ag。
向含硝酸镁、硝酸亚铁、硝酸银的混合溶液中加入一定量的锌,锌先和硝酸银反应生成硝酸锌和银,硝酸银完全反应后,锌和硝酸亚铁反应生成硝酸锌和铁,锌和硝酸镁不反应,得到的溶液甲为无色,硝酸亚铁溶液显浅绿色,则硝酸银和硝酸亚铁都完全反应,溶液甲中不含硝酸亚铁和硝酸银,含硝酸镁和硝酸锌,得到的固体X中一定有银、铁,可能有锌(锌过量),固体X加过量稀硫酸得到固体Y和溶液乙,银和稀硫酸不反应,铁和稀硫酸反应生成硫酸亚铁和氢气,若固体X中含有锌,锌和稀硫酸反应生成硫酸锌和氢气,固体Y是银,溶液乙中一定含有硫酸和硫酸亚铁,可能有硫酸锌。
(1)通过分析可知,X中一定含有的金属是银、铁。故答案为:铁和银(Fe和Ag);
(2)通过分析可知,加入稀硫酸一定发生的反应是铁和稀硫酸反应生成硫酸亚铁和氢气。故答案为:![]() ;
;
(3)通过分析可知,溶液甲为无色,不含硝酸亚铁(硝酸亚铁溶液显浅绿色),则一定不含硝酸银。因为银的金属活动性弱于铁,铁弱于锌,锌先和硝酸银反应,硝酸银完全反应后,锌和硝酸亚铁反应。故答案为:溶液甲无色,溶液中无Fe(NO3)2,则一定没有AgNO3,因为Zn先与AgNO3反应,后与Fe(NO3)2反应。

【题目】小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。
(提出问题)白色粉末的成分是什么?
(进行猜想)他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物。
(设计实验)
(1)为了验证猜想,小军做了下面的实验:
序号 | 实验操作 | 实验现象 | 结论 |
1 | 取少量白色粉末,滴加足量稀盐酸 | 气体生成 | 猜想______不正确 |
2 | 取少量白色粉末溶于水,向所得溶液中滴加无色酚酞溶液 | ________________ | 猜想③正确 |
(反思改进)
(2)小红认为小军实验2不能得出猜想③正确,请说明理由__________________
(3)小刚认为小红说的对,为了验证猜想③,设计以下实验:
序号 | 实验操作 | 实验现象 | 结论 |
Ⅰ | 取少量白色粉末溶于水,向所得溶液中滴加过量 _________溶液 | 产生白色沉淀 | 猜想③正确 |
Ⅱ | 取实验Ⅰ的上清液,向溶液中滴加FeCl3溶液 | _______________ |
请你写出实验Ⅰ中反应的化学方程式____________。
(反思应用)氢氧化钠易潮解,且容易与空气中CO2发生反应,所以氢氧化钠固体应该_________保存。