题目内容
【题目】化学实验操作的规范性、安全性是实验成败的关键,同时也反映了实验者的化学素养,下列实验操作中改正错误后仍不正确的是( )
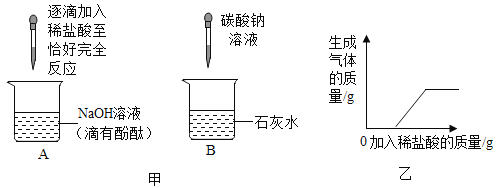
A.制备二氧化碳,长颈漏斗应伸入液面以下
B.测定空气中氧气含量,实验应将木炭改为红磷
C.测定溶液的pH,应用玻璃棒蘸取溶液滴在pH试纸上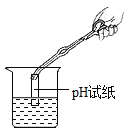
D.验证质量守恒定律,该化学反应应在密闭容器中进行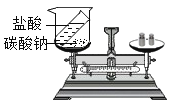
【答案】A
【解析】
A、为防止二氧化碳逸出,制备二氧化碳,长颈漏斗应伸入液面以下,但稀硫酸与碳酸钙反应会生成微溶的硫酸钙覆盖在碳酸钙表面,阻止反应的进一步进行,不能持续地得到二氧化碳,改正错误后仍不正确,符合题意;
B、测定空气中氧气含量,实验若将木炭改为红磷,红磷燃烧生成固体五氧化二磷,瓶内的气压降低,冷却后打开止水夹,在大气压作用下水进入集气瓶,进入水体积等于空气中氧气体积,改正错误后正确,不符合题意;
C、测定溶液的pH,应用玻璃棒蘸取溶液滴在pH试纸上,改正错误后正确,不符合题意;
D、验证质量守恒定律,该化学反应应在密闭容器中进行,改正错误后正确,不符合题意。故选A。

【题目】阅读下列科普短文并回答问题:

纯碱的用途非常广泛。纯碱工业始创于18 世纪,西方国家对这一技术采取了严格的保密措施。一些专家想探索此项技术的秘密,均以失败告终。1943年,我国化学工程专家侯德榜针对西方纯碱生产时食盐利用率低,制碱成本高,废液、废渣污染环境和难以处理等不足,发明了侯氏制碱法又称联合制碱法。
发明原理
第一步:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体。
第二步:碳酸氢铵与氯化钠反应生成氯化铵和碳酸氢钠沉淀。
第三步:在5℃~ 10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。向时液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。NH3、CO2 都来自于合成氨工艺:这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
第四步:加热碳酸氢钠制取纯碱。
温度溶解度物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
NH4HCO3 | 11.9 | 16.1 | 21.7 | 28.4 | 36.6 | 44.1 | 59.2 |
NaHCO3 | 6.9 | 8.15 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
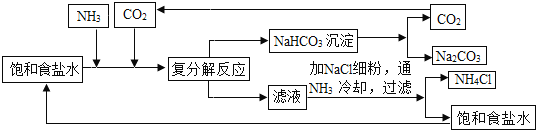
阅读短文,回答下列问题:
(1)写出侯氏制碱法第二步的化学反应方程式_____。
(2)饱和食盐水中持续通入氨气和二氧化碳气体后,溶液中大量存在的离子有_____。
(3)第二步的复分解反应发生时,常温下向溶液中持续通入氨气和二氧化碳气体,碳酸氢钠以沉淀的形式先析出的原因是_____。
(4)写出侯氏制碱法的一个优点_____。
(5)循环利用的物质是_____。
(6)侯氏制碱法中没有涉及的化学反应类型是_____。
(7)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,_____。
【题目】小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。
(提出问题)白色粉末的成分是什么?
(进行猜想)他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物。
(设计实验)
(1)为了验证猜想,小军做了下面的实验:
序号 | 实验操作 | 实验现象 | 结论 |
1 | 取少量白色粉末,滴加足量稀盐酸 | 气体生成 | 猜想______不正确 |
2 | 取少量白色粉末溶于水,向所得溶液中滴加无色酚酞溶液 | ________________ | 猜想③正确 |
(反思改进)
(2)小红认为小军实验2不能得出猜想③正确,请说明理由__________________
(3)小刚认为小红说的对,为了验证猜想③,设计以下实验:
序号 | 实验操作 | 实验现象 | 结论 |
Ⅰ | 取少量白色粉末溶于水,向所得溶液中滴加过量 _________溶液 | 产生白色沉淀 | 猜想③正确 |
Ⅱ | 取实验Ⅰ的上清液,向溶液中滴加FeCl3溶液 | _______________ |
请你写出实验Ⅰ中反应的化学方程式____________。
(反思应用)氢氧化钠易潮解,且容易与空气中CO2发生反应,所以氢氧化钠固体应该_________保存。