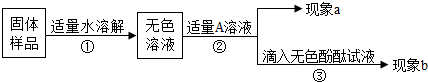
题目内容
酸,碱,盐是有广泛用途的重要化学物质.试完成下列人关探究.
(1)实验室里有一瓶敞口放置的浓盐酸,它的质量分数与放置天数的关系如图A所示.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.
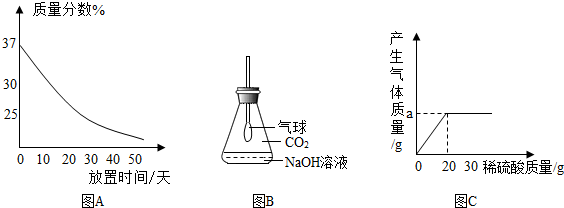
(2)观察图B中的装置,向事先收集满CO2气体的锥形瓶中倒入一定量的氢氧化钠溶液,塞紧瓶塞振荡,可观察到的现象是______.
(3)馒头、面包等发面食品松软可口,它们有一个共同特点是面团中有许多小孔.根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用.
(4)在常温下将HCl、NaCl、NaOH、Ca(OH)2、Na2CO3等几种溶液两两混合.
①当HCl与NaOH或Ca(OH)2溶液后,虽然发生了反应,但观察不到明显现象.请你设计一个实验方案证明它们确实发生了化学反应.
②若混合后溶液的质量减少,试写出所有可能的组合.
③将溶质质量分数为19.6%的稀硫酸逐滴加入Na2CO3溶液中,若产生气体质量与加入稀硫酸的质量有如图C所示关系,求a的数值.
解:(1)浓盐酸的溶质质量分数变化的原因是:浓盐酸具有挥发性,HCl气体挥发,导致溶质减少,溶质质量分数减少;
(2)氢氧化钠溶液吸收二氧化碳后,锥形瓶中的压强减小,可观察到气球膨胀起来;
故填:气球膨胀;
(3)碳酸氢钠在其中的作用是:碳酸氢钠与有机酸反应,产生大量二氧化碳气体,留下气孔,使面食松软可口;
(4)①实验方案为:
向氢氧化钠或氢氧化钙溶液中滴加无色酚酞溶液,然后再向其中加入稀盐酸,若观察到溶液由红色逐渐变为无色,则证明发生了化学反应.
②Na2CO3和HCl混合时,碳酸钠和盐酸反应能生成氯化钠、水和二氧化碳,二氧化碳从溶液中逸出,溶液质量减小;
Na2CO3和Ca(OH)2混合时,碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙沉淀,碳酸钙从溶液中析出,溶液质量减小;
③解:H2SO4+Na2CO3═Na2SO4+H2O+CO2↑,
98 44
20g×19.6% a
98/44=(20g×19.6%)/a,
a=1.76g,
答:a的数值是1.76g.
分析:(1)盐酸具有挥发性;
(2)氢氧化钠溶液能够吸收二氧化碳气体;
(3)碳酸氢钠和显酸性物质反应能生成二氧化碳气体;
(4)显碱性的溶液能使酚酞试液变红色,显中性的溶液不能使酚酞试液变色;
通过计算可以确定a的数值.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.
(2)氢氧化钠溶液吸收二氧化碳后,锥形瓶中的压强减小,可观察到气球膨胀起来;
故填:气球膨胀;
(3)碳酸氢钠在其中的作用是:碳酸氢钠与有机酸反应,产生大量二氧化碳气体,留下气孔,使面食松软可口;
(4)①实验方案为:
向氢氧化钠或氢氧化钙溶液中滴加无色酚酞溶液,然后再向其中加入稀盐酸,若观察到溶液由红色逐渐变为无色,则证明发生了化学反应.
②Na2CO3和HCl混合时,碳酸钠和盐酸反应能生成氯化钠、水和二氧化碳,二氧化碳从溶液中逸出,溶液质量减小;
Na2CO3和Ca(OH)2混合时,碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙沉淀,碳酸钙从溶液中析出,溶液质量减小;
③解:H2SO4+Na2CO3═Na2SO4+H2O+CO2↑,
98 44
20g×19.6% a
98/44=(20g×19.6%)/a,
a=1.76g,
答:a的数值是1.76g.
分析:(1)盐酸具有挥发性;
(2)氢氧化钠溶液能够吸收二氧化碳气体;
(3)碳酸氢钠和显酸性物质反应能生成二氧化碳气体;
(4)显碱性的溶液能使酚酞试液变红色,显中性的溶液不能使酚酞试液变色;
通过计算可以确定a的数值.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.

练习册系列答案
相关题目
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)熟石灰是一种重要的碱,在工农生产和日常生活中都有十分广泛的应用.工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰.请你写出有关反应的化学方程式.
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
(5)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
 18、酸、碱、盐是有广泛用途的重要化合物.
18、酸、碱、盐是有广泛用途的重要化合物. 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.