题目内容
(2013?开封一模)酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)常见的酸有盐酸、硫酸等,由于在溶液中存在有相同的
(2)氢氧化钠是重要的化工原料,在保存的过程中如果密封不严容易变质.实验室有一瓶久置的氢氧化钠固体,为了探究该氢氧化钠固体是否变质,同学们进行了如下实验: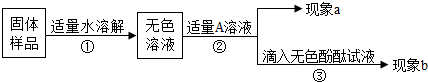
①氢氧化钠变质的原因是
②若现象a为有气泡产生,则加入的A溶液可能是
③进一步探究产品变质的程度,再加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为有白色沉淀,现象b为无色酚酞试液变红色,则证明该氢氧化钠固体
(3)海水中含有丰富的氯化钠,利用风吹日晒可以从海水中提取粗盐,风吹日晒的作用是
(4)若73g质量分数为20%的盐酸与一定质量的氢氧化钠溶液恰好完全反应,生成的氯化钠溶液的质量为233g,试计算该氢氧化钠溶液的溶质质量分数.
(1)常见的酸有盐酸、硫酸等,由于在溶液中存在有相同的
H+
H+
(填化学符号)而有相似的化学性质;稀释浓硫酸时,不可将水倒进浓硫酸里的原因是水的密度较小,浮在浓硫酸上面
水的密度较小,浮在浓硫酸上面
,溶解时放出的热会使水沸腾,造成酸液飞溅
溶解时放出的热会使水沸腾,造成酸液飞溅
.(2)氢氧化钠是重要的化工原料,在保存的过程中如果密封不严容易变质.实验室有一瓶久置的氢氧化钠固体,为了探究该氢氧化钠固体是否变质,同学们进行了如下实验:

①氢氧化钠变质的原因是
2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
(用化学方程式表示).②若现象a为有气泡产生,则加入的A溶液可能是
稀盐酸
稀盐酸
,说明氢氧化钠已经变质.③进一步探究产品变质的程度,再加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为有白色沉淀,现象b为无色酚酞试液变红色,则证明该氢氧化钠固体
部分
部分
(填“部分”或“完全”)变质.(3)海水中含有丰富的氯化钠,利用风吹日晒可以从海水中提取粗盐,风吹日晒的作用是
蒸发除去水分
蒸发除去水分
;欲用化学方法除去粗盐中混有的少量氯化镁,可将粗盐溶解后,加入适量的氢氧化钠
氢氧化钠
溶液.(4)若73g质量分数为20%的盐酸与一定质量的氢氧化钠溶液恰好完全反应,生成的氯化钠溶液的质量为233g,试计算该氢氧化钠溶液的溶质质量分数.
分析:(1)根据酸的定义进行分析,根据浓硫酸的稀释的注意事项进行分析,
(2)①掌握氢氧化钠变质的原因;
②根据氢氧化钠的特点考虑:氢氧化钠易与空气中二氧化碳反应生成碳酸钠,加入的物质与碳酸根离子能产生气体,来考虑加入的物质;
③过量的CaCl2溶液与碳酸钠反应,把碳酸钠全部消耗,再考虑加入酚酞变色情况.氢氧化钠变质是与二氧化碳反应导致.
(3)根据晒盐的原理分析即可;根据氢氧化钠会而会和氯化镁反应生成沉淀进行分析
(4)反应后所得溶液是氯化钠溶液,根据化学方程式NaOH+HCl=NaCl+H2O,可以计算生成氯化钠的质量,最后用氯化钠的质量除以所得溶液的质量乘以百分之百便可得反应后所得溶液中溶质的质量分数.
(2)①掌握氢氧化钠变质的原因;
②根据氢氧化钠的特点考虑:氢氧化钠易与空气中二氧化碳反应生成碳酸钠,加入的物质与碳酸根离子能产生气体,来考虑加入的物质;
③过量的CaCl2溶液与碳酸钠反应,把碳酸钠全部消耗,再考虑加入酚酞变色情况.氢氧化钠变质是与二氧化碳反应导致.
(3)根据晒盐的原理分析即可;根据氢氧化钠会而会和氯化镁反应生成沉淀进行分析
(4)反应后所得溶液是氯化钠溶液,根据化学方程式NaOH+HCl=NaCl+H2O,可以计算生成氯化钠的质量,最后用氯化钠的质量除以所得溶液的质量乘以百分之百便可得反应后所得溶液中溶质的质量分数.
解答:解:(1)在溶液中电离出的阳离子全部是氢离子的化合物就是酸,所以酸中都有相同的离子氢离子;稀释浓硫酸时,不可将水倒进浓硫酸里的原因是 水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水沸腾,造成酸液飞溅.
(1)①氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应,则化学方程式为 2NaOH+CO2═Na2CO3+H2O;
②氢氧化钠易与空气中二氧化碳反应生成碳酸钠,由于碳酸根遇到酸能产生气体二氧化碳,所以加入的物质是盐酸就行;
③氢氧化钠变质后有两种情况:全变质,部分变质,全变质就是全部为碳酸钠,部分变质是既有氢氧化钠也有碳酸钠,过量的CaCl2溶液把碳酸钠全部反应掉,再加入酚酞变红,说明显碱性溶液中含有氢氧化钠,所以部分变质;
(2)从海水中提取食盐采用蒸发结晶的方法,风吹日晒是为了加速水分的蒸发;所有的钠盐都溶于水,而氢氧根离子会将镁离子转化为氢氧化镁沉淀,剩余氯化钠;
(3)解:设反应生成的NaCl的质量为x.
NaOH+HCl═NaCl+H2O
36.5 58.5
73g×20% x
=
,解得x=23.4g
所以反应后所得溶液中溶质的质量分数为
×100%=11%
答:反应后所得溶液中溶质的质量分数为11%.
故答案为:(1)H+; 水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水沸腾,造成酸液飞溅(答案合理即可)
(2)①2NaOH+CO2═Na2CO3+H2O; ②稀盐酸; ③部分
(3)蒸发除去水分;氢氧化钠;
(4)11%
(1)①氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应,则化学方程式为 2NaOH+CO2═Na2CO3+H2O;
②氢氧化钠易与空气中二氧化碳反应生成碳酸钠,由于碳酸根遇到酸能产生气体二氧化碳,所以加入的物质是盐酸就行;
③氢氧化钠变质后有两种情况:全变质,部分变质,全变质就是全部为碳酸钠,部分变质是既有氢氧化钠也有碳酸钠,过量的CaCl2溶液把碳酸钠全部反应掉,再加入酚酞变红,说明显碱性溶液中含有氢氧化钠,所以部分变质;
(2)从海水中提取食盐采用蒸发结晶的方法,风吹日晒是为了加速水分的蒸发;所有的钠盐都溶于水,而氢氧根离子会将镁离子转化为氢氧化镁沉淀,剩余氯化钠;
(3)解:设反应生成的NaCl的质量为x.
NaOH+HCl═NaCl+H2O
36.5 58.5
73g×20% x
| 36.5 |
| 58.5 |
| 73g×20% |
| x |
所以反应后所得溶液中溶质的质量分数为
| 23.4g |
| 233g |
答:反应后所得溶液中溶质的质量分数为11%.
故答案为:(1)H+; 水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水沸腾,造成酸液飞溅(答案合理即可)
(2)①2NaOH+CO2═Na2CO3+H2O; ②稀盐酸; ③部分
(3)蒸发除去水分;氢氧化钠;
(4)11%
点评:解答本题要注意变质后的溶液不能直接用酚酞溶液来判断,因为变质后的碳酸钠也显碱性;还考查根据化学方程式计算和溶质质量分数的计算,难度不大.

练习册系列答案
相关题目
 (2013?开封一模)如图是A、B两种固体的溶解度曲线,下列说法正确的是( )
(2013?开封一模)如图是A、B两种固体的溶解度曲线,下列说法正确的是( ) (2013?信阳一模)酸和碱能发生中和反应,生成盐和水.已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,图中表示向甲中加入乙时溶液pH的变化曲线,请你写出图中所获取的信息.(写三条)
(2013?信阳一模)酸和碱能发生中和反应,生成盐和水.已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,图中表示向甲中加入乙时溶液pH的变化曲线,请你写出图中所获取的信息.(写三条)