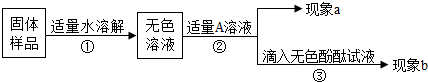
题目内容
(2011?开封一模)酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.(1)盐酸、硫酸等具有相似的化学性质,是因为二者的水溶液中都含有______离子.打开盛浓盐酸和浓硫酸的试剂瓶的瓶盖,立即就能把它们区分开来,这是因为______.
(2)如图是甲同学设计的趣味实验装置,其气密性良好.若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后能观察到什么现象?并写出有关反应的化学方程式.
(3)盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.乙同学和丙同学对这种白色粉末的成分进行了如下猜想和验证.
(Ⅰ)可能是NaOH(Ⅱ)可能是Na2CO3(Ⅲ)可能是NaOH与Na2CO3的混合物
①乙同学向所取少量粉末中滴加一种溶液后,排除了(Ⅰ)的可能性.请你推测他所加的试剂和观察到的现象.
②丙同学提议用酚酞试液来鉴定,你认为可行吗?请简要说明理由.
(4)某同学对附近一家化工厂排放的污水中的氢氧化钠含量进行了测定.他取了40g污水于烧杯中,逐滴加入5%的稀盐酸中和,当恰好完全反应时,用去稀盐酸7.3g.请计算废水中氢氧化钠的质量分数.

【答案】分析:(1)根据酸的定义进行分析,
根据浓盐酸和浓硫酸的溶质进行分析,
(2)根据锥形瓶中的气压进行分析,
根据反应物、生成物书写方程式.
(3)①根据碳酸盐与酸反应会生成二氧化碳气体进行分析,
②根据酸碱指示剂的变色进行分析.
(4)根据题中的反应原理书写方程式,然后根据比例关系进行解答.
解答:解:(1)在溶液中电离出的阳离子全部是氢离子的化合物就是酸,所以酸中都有相同的离子氢离子,故答案为:氢
盐酸的溶质是氯化氢具有挥发性,氯化氢会与水蒸气生成盐酸小液滴,而硫酸的溶质是硫酸,不具有挥发性,故答案为:瓶口出现白雾的是浓盐酸,因为浓盐酸有挥发性
(2)二氧化碳与氢氧化钠反应,是锥形瓶中的气压减小,外界大气压会使U性管中的页面产生高度差,故答案为:U形管中红墨水的液面左高右低
二氧化碳和氢氧化钠反应生成碳酸钠和水,故答案为:CO2+2NaOH=Na2CO3+H2O
(3)①第一种猜想中没有碳酸钠,而后面的两种猜想中都有碳酸钠,根据碳酸钠的性质,可知滴入了盐酸,故答案为:所加试剂是稀盐酸等,观察到的现象是有气泡产生
②酚酞遇到碱性溶液都会变色,而碳酸钠和氢氧化钠都显碱性,故答案为:不可行,氢氧化钠溶液和碳酸钠溶液都呈碱性.
(3)解:设废水中氢氧化钠的质量为x.
NaOH+HCl=NaCl+H2O
40 36.5
x 7.3g×5%
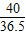 =
=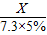 ,X=0.4g
,X=0.4g
NaOH%=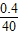 ×100%=1%
×100%=1%
答:废水中氢氧化钠的质量分数为1%.
点评:在解此类题时,首先分析题目考查的意图,然后找出问题与书本知识的切入点,然后再根据学过的知识进行解答.
根据浓盐酸和浓硫酸的溶质进行分析,
(2)根据锥形瓶中的气压进行分析,
根据反应物、生成物书写方程式.
(3)①根据碳酸盐与酸反应会生成二氧化碳气体进行分析,
②根据酸碱指示剂的变色进行分析.
(4)根据题中的反应原理书写方程式,然后根据比例关系进行解答.
解答:解:(1)在溶液中电离出的阳离子全部是氢离子的化合物就是酸,所以酸中都有相同的离子氢离子,故答案为:氢
盐酸的溶质是氯化氢具有挥发性,氯化氢会与水蒸气生成盐酸小液滴,而硫酸的溶质是硫酸,不具有挥发性,故答案为:瓶口出现白雾的是浓盐酸,因为浓盐酸有挥发性
(2)二氧化碳与氢氧化钠反应,是锥形瓶中的气压减小,外界大气压会使U性管中的页面产生高度差,故答案为:U形管中红墨水的液面左高右低
二氧化碳和氢氧化钠反应生成碳酸钠和水,故答案为:CO2+2NaOH=Na2CO3+H2O
(3)①第一种猜想中没有碳酸钠,而后面的两种猜想中都有碳酸钠,根据碳酸钠的性质,可知滴入了盐酸,故答案为:所加试剂是稀盐酸等,观察到的现象是有气泡产生
②酚酞遇到碱性溶液都会变色,而碳酸钠和氢氧化钠都显碱性,故答案为:不可行,氢氧化钠溶液和碳酸钠溶液都呈碱性.
(3)解:设废水中氢氧化钠的质量为x.
NaOH+HCl=NaCl+H2O
40 36.5
x 7.3g×5%
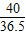 =
=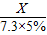 ,X=0.4g
,X=0.4gNaOH%=
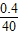 ×100%=1%
×100%=1%答:废水中氢氧化钠的质量分数为1%.
点评:在解此类题时,首先分析题目考查的意图,然后找出问题与书本知识的切入点,然后再根据学过的知识进行解答.

练习册系列答案
相关题目