题目内容
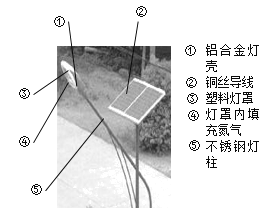
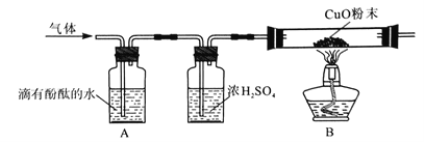
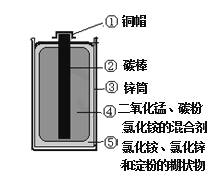
【题目】普通电池(锌锰电池)含有多种材料,结构如图。
请你根据图示分析:
①图中金属单质有________种,化合物中除有机物外, 无机物还含有_______、_________(填写物质种类名称)。
②写出氯化铵的化学式 _______,在农业上它的 用途是 _________。
③碳棒起导电作用,这是利用了碳棒的______(选填“物理”或“化学”)性质。
④拆解后经处理得到 65g 锌,则所含锌原子个数约为______(用科学记数法表示)。
【答案】 二 盐 氧化物 NH4Cl 化肥 物理 6.02×1023
【解析】由图示信息可知①图中金属单质有铜和锌两种,化合物中除有机物外, 无机物还含有氯化铵、氯化锌和二氧化锰,氯化铵和氯化锌属于盐,二氧化锰属于氧化物;氯化铵中铵根显+11价,氯元素显-1价,故氯化铵的化学式为:NH4Cl;在农业上它的 用途是化肥;③碳棒起导电作用,这是利用了碳棒的物理性质;④拆解后经处理得到 65g 锌,则所含锌原子个数约为![]() 个。
个。

 全优点练单元计划系列答案
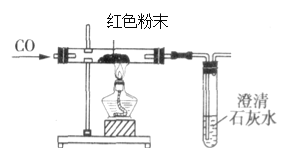
全优点练单元计划系列答案【题目】一包干燥的红色粉末,由Cu、Fe2O3、Fe(OH)3三种固体中的一种或两种组成。下面是同学们的探究过程,请你参与并回答有关问题。
【提出问题】
猜想①:只有Cu 猜想②:只有Fe2O3
猜想③:只有Fe(OH)3 猜想④:是Fe(OH)3和Fe2O3的混合物
猜想⑤:是Cu、Fe2O3的混合物 猜想⑥是____的混合物
【查阅资料】
(1)2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
(2)Cu溶解在Fecl3溶液中,得到FeCl2和CuCl2
[实验探究]
(3)甲同学进行下列实验,请你填写表中空白处。
实验操作步骤 | 实验现象 | 结论 |
①取用少量红色固体,放于试管中加热 | 固体没有明显变化,试管口附近内壁没有发现小液滴 | 红色固体不含________ |
②取少量红色粉末于试管中,滴加足量的稀盐酸 | 发现固体全部溶解,溶液变色 | 猜想_____可能成立,所可能涉及的化学反应方程式是___ |
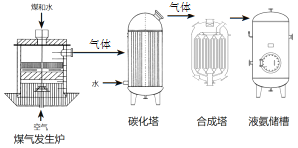
(4)在甲同学实验的基础上,乙同学为进一步确定红色粉末的组成,称取该粉末10.0g装入硬质玻璃管中,按右图装置进行实验。实验时发现澄清石灰水变浑浊,证明红色粉末中含有Fe2O3硬质玻璃管中发生反应的化学方程式是______反应完全后测得石灰水质量增加6.6g(假定CO足够多,石灰水足量,产生气体全部被吸收)则请计算出该红色粉末中各成分的质量____
【反思评价】丙同学指出:从环保角度,乙同学的实验装置有严重不足之处。请提出你的具体改进措施及原因:________________
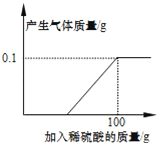
【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
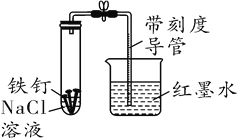
(1)实验前用10%的H2SO4溶液清洗铁钉至有气泡产生。用H2SO4溶液清洗的目的是__________。写出有关化学方程式______________________________。
(2)已知试管剩余空间和导管的体积为40 mL,导管截面积约为1 cm2,形成稳定液柱时,读取读数为8.2 cm。则空气中氧气的体积分数为______%。
(3)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
【提出假设】假设一:溶液的pH不同;
假设二:NaCl溶液的浓度不同;
请你再提出一种假设,假设三:______________________________不同。
【进行实验】借助上述实验装置,通过取体积、浓度相同NaCl溶液调节溶液的pH获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度(cm) | 0 | 1.3 | 8.2 | 8.2 | 8.2 | 8.2 |
形成稳定液柱时间(min) | 3.0 | 3.0 | 5.1 | 5.3 | 15.6 | 17.5 |
【实验结论】根据实验数据分析,为缩短实验测定时间,pH的最佳范围是____________。
【实验反思】当pH=2时,没有观察到稳定液柱形成的原因是________________。
【注意:如果能正确回答下列问题,将奖励4分,但化学试卷总分不超过60分】
请你设计实验,探究NaCl溶液的浓度对铁生锈速率的影响。
实验步骤: __________________________________________________________。
实验现象:________________________________________________________________。