题目内容
【题目】下面是甲、乙实验小组完成的相关实验。
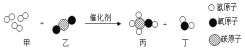
甲小组:利用下图装置研究燃烧条件(已知白磷的着火点为40℃)。
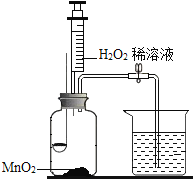
步骤Ⅰ:烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞。
步骤Ⅱ:用注射器向瓶内推入适量H2O2 溶液
(1)H2O2稀溶液与MnO2接触时发生反应的文字表达式为_____;
(2)实验中,推入H2O2溶液前,燃烧匙中的白磷不燃烧,原因是_____;推入H2O2溶液后,观察到烧杯中的现象是_____。
乙小组:哪些因素影响过氧化氢分解的速率?
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)通过实验对比可知,化学反应速率与浓度和温度有关系。
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子相互接触、碰撞的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:_____;
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量_____(填“减小”或“不变”或“增大”)。
【答案】过氧化氢![]() 水+氧气 温度没有达到着火点 导管口有气泡冒出,且白磷燃烧 反应物的分子接触碰撞的机会多 不变
水+氧气 温度没有达到着火点 导管口有气泡冒出,且白磷燃烧 反应物的分子接触碰撞的机会多 不变
【解析】
过氧化氢在二氧化锰催化作用下生成水和氧气,燃烧的条件:物质是可燃物、温度达到可燃物着火点、有氧气参与。
甲小组:(1)H2O2稀溶液与MnO2接触时生成水和氧气,反应的文字表达式为
过氧化氢![]() 水+氧气。
水+氧气。
(2)根据燃烧的条件可知,燃烧匙中白磷不燃烧是因为未达到白磷的着火点,推入H2O2溶液后,生成氧气,氧气通过导管进入烧杯,所以观察到烧杯中的现象是导管口有气泡冒出,且白磷燃烧。
乙小组:(2)“反应物浓度越大,化学反应速率越快”是因为反应物的分子接触碰撞的机会多。
(3)加水稀释,过氧化氢的质量不变,故产生的氧气的质量不变。

 期末集结号系列答案
期末集结号系列答案