��Ŀ����
����Ŀ��̼��ƿ�����Ԥ�������Ƹ�ȱ��֢��ijʵ��С��ͬѧҪ�ⶨһ�ָ�Ƭ��̼��Ƶĺ����� �������ϣ���õ������У�
�ٲ��Ƽ��г��������ࡢά����D�ȸ��ƿڸл���ǿҩЧ����Щ���ʲ���ϡ���ᷴӦ�������壬��������ʱ��ȼ�ջ�ֽ⣮
��̼��Ƹ������շֽ����������ƺͶ�����̼��
�۳�����̼��ƺ����ⶨ��������̼��Ʒ��飬������֪Ũ�ȵĹ��������ַ�Ӧ��Ȼ���ʣ���������������������������������̼��Ƶĺ�����
�ܳ���ʯ��ˮ�е�Ca��OH��2�������٣�100g����ʯ��ˮ����ຬ0.15gCa��OH��2 ��
��������ƺ�ʵʩ���������Ϻ���ѧ֪ʶ����С��ͬѧ����������ַ������вⶨ��
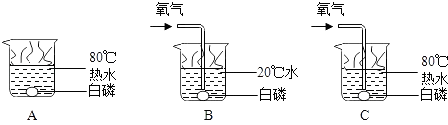
����1��������ͼ��ʾװ��ʵ�飮
��1����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2������©���²�����Һ���µ�Ŀ����
��3������ҩƷǰ�������װ�������Եķ�����
��4����¼�������£�
��Ƭ���� | ��ϴ��ƿ���� | ����ʯ��ˮ������ | ��Ӧ��ϴ��ƿ��ƿ������������ |
25g | 100g | 200g | 300.4g |
����2������Ƭ���飬����������ϡ�����ַ�Ӧ�����ݷų������������̼��Ƶĺ�������¼�������£����ձ�����Ϊ100g�������Ƭ����Ϊ25g����
����ϡ��������� | 100g | 200g | 300g | 400g |
��ַ�Ӧ���ձ����������������� | 222.8g | 320.6g | 418.4g | 518.4g |
�����������ۡ�
����1�ͷ���2�к������� �� ԭ���� ��
��5����С��ͬѧû��ʹ��̼��Ƹ������շֽ�ķ���������ʵ���ҿ��Խ��и�ʵ�飩��ԭ���� ��
��6��Ҫʹ�ò������Ϣ��н��ܵķ���������Ҫѧϰ���� ��
��7�������ۡ��������㣬�ø�Ƭ��̼��Ƶ����������� �� 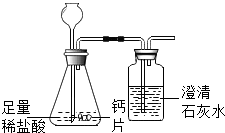
���𰸡�
��1��CaCO3+2HCl�TCaCl2+H2O+CO2��
��2����ֹCO2�����ݳ���Һ�⣩
��3����ס���ܣ���ס���ܳ��ڣ����ӳ���©����ˮ������©����Һ�������ƿ��Һ�棬��һ��ʱ�䲻�½�����֤����װ�����������ã�����������
��4������2������ʯ��ˮ�е�Ca��OH��2�������٣����㣩�����յĶ�����̼������
��5����������ࡢά����D�����ʸ�������ʱ��ȼ�ջ�ֽ⣬�������յ�����ƫ��
��6����βⶨδ֪Ũ�ȣ�ʣ�ࣩ�������
��7��60%
���������⣺��������ƺ�ʵʩ����1������������Ϣ�����Ƽ��г�̼������������ʲ���ϡ���ᷴӦ����ƿ�з���̼�����ϡ���ᷴӦ����ѧ����ʽΪ CaCO3+2HCl�TCaCl2+H2O+CO2������2��Ϊ��ֹ������̼�������������©���²�Ӧ����Һ���£���3������ҩƷǰӦ���װ�õ������ԣ���ס���ܣ���ס���ܳ��ڣ����ӳ���©����ˮ������©����Һ�������ƿ��Һ�棬��һ��ʱ�䲻�½�����֤����װ�����������ã������������ۡ���4����Ϊ���������ܣ�����ʯ��ˮ�е�Ca��OH��2�������٣����յĶ�����̼�����٣����Է���2��������5���������ϲ��Ƽ������ࡢά����D��Ч����������ʱ��ȼ�ջ�ֽ⣬������������ƫ����ʹ��̼��Ƹ������շֽ�ķ�������6��Ҫʹ�ò������Ϣ��н��ܵķ���������Ҫѧϰ������β�δ֪Ũ�ȣ�ʣ�ࣩ������������ܼ���������������������̼��Ƶĺ�������7����������������������Ƭ��̼��Ƶĺ�����
�����ۡ���ʵ���¼��֪������300g����ʱ̼�������ȫ��Ӧ�����ɶ�����̼������Ϊ����300+100+25����418.4=6.6g
��̼�����������ȫ��Ӧ����6.6g������̼����Ҫ̼��Ƶ�����Ϊx
CaCO3+2HCl�TCaCl2+H2O+C | CO2�� |
100 | 44 |
X | 6.6g |
![]()
x=15g
��Ƭ��̼��Ƶ���������Ϊ ![]() ��100%=60%��
��100%=60%��
���Դ��ǣ�
������Ƽ�ʵʩ��1��CaCO3+2HCl�TCaCl2+H2O+CO2������2����ֹCO2�����ݳ���Һ�⣩����3����ס���ܣ���ס���ܳ��ڣ����ӳ���©����ˮ������©����Һ�������ƿ��Һ�棬��һ��ʱ�䲻�½�����֤����װ�����������ã�
���������ۣ���1������2������ʯ��ˮ�е�Ca��OH��2�������٣����㣩�����յĶ�����̼�����٣���2����������ࡢά����D�����ʸ�������ʱ��ȼ�ջ�ֽ⣬�������յ�����ƫ�� ��3����βⶨδ֪Ũ�ȣ�ʣ�ࣩ���������
�����ۡ�60%��
�����㾫�������ռ��װ�õ������Ժ���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�ǽ����ĸ�������Ҫ֪��װ�������Լ�飺�Ƚ����ܵ�һ�˽���ˮ�У����ֽ���������ڣ���ͣƬ�̣������ܿ�������ð�����ɿ����ƣ����ܿڲ���ˮ����������ͣƬ�̣�ˮ���������䣬��˵��װ�ò�©����ע�⣺a����ƽ b������ c�����ţ�