题目内容
【题目】为验证Zn、Cu、Ag三种金属的活动性顺序,可选用的试剂是
A. CuSO4溶液 B. 稀盐酸 C. AgNO3溶液 D. ZnSO4溶液
【答案】A
【解析】A、锌可以置换CuSO4溶液中的铜而出现红色固体,证明锌的活动性比铜强;银和CuSO4溶液不反应,证明铜比银的活动性强。可以证明三种金属的活动性强弱,正确; B、试剂中铜、银都不能与稀盐酸反应,无法比较金属铜与银的活泼性的大小,错误;C、试剂中锌、铜都能与AgNO3溶液反应,无法比较金属锌与铜的活泼性的大小,错误;D、在金属活动性顺序中,铜、银都在锌的后面,不能与硫酸锌反应,不能比较铜和银的活动性顺序,错误。故选A。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】下列图象能正确反映对应变化关系的处( )
|
|
|
|
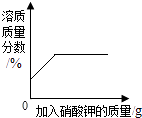
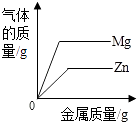
20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体 | 加热一定量的高锰酸钾固体 | 向一定量的二氧化锰中加入过氧化氢溶液 | 向两份完全相同的稀盐酸中分别加入锌粉、镁粉至过量 |
A.A
B.B
C.C
D.D
【题目】碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量. 查阅资料:获得的资料有:
①补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
②碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
③常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
④澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15gCa(OH)2 .
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
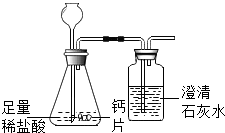
方案1:根据如图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为 .
(2)长颈漏斗下部插入液面下的目的是
(3)加入药品前,检验该装置气密性的方法是
(4)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
25g | 100g | 200g | 300.4g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
【分析和评价】
方案1和方案2中合理的是 , 原因是 .
(5)该小组同学没有使用碳酸钙高温灼烧分解的方法(假设实验室可以进行该实验),原因是 .
(6)要使用查阅资料③中介绍的方法,还需要学习的是 .
(7)【结论】经过计算,该钙片中碳酸钙的质量分数是 .