题目内容
【题目】氢氧化钠是实验室常用的一种化学药品。
(1)制取少量氢氧化钠可以用下面的流程:
![]()
①写出步骤②的化学方程式__________________。
②氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂________________(填序号)。
A 硼酸溶液
B 3-5%的碳酸氢钠溶液
C 稀硫酸
D 石灰水
(2)室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到100g硫酸铜溶液中。当滴入氢氧化钠溶液80g时,恰好完全反应。
①滴加过程中产生的明显现象_________________。
②加氢氧化钠溶液至40g时,溶液里含有的溶质为__________________(写化学式)。
③求硫酸铜溶液的质量分数________________。
【答案】![]() A 产生蓝色沉淀 CuSO4 、Na2SO4 16%。
A 产生蓝色沉淀 CuSO4 、Na2SO4 16%。
【解析】
(1)①步骤②中氧化钙和水反应生成氢氧化钙,化学方程式CaO+ H2O= Ca(OH)2;
②氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂酸性物质,将残留的氢氧化钠中和掉:
A、 硼酸溶液能和氢氧化钠发生中和反应,且硼酸没有腐蚀性,将残留氢氧化钠反应掉;
B、3-5%的碳酸氢钠溶液与氢氧化钠溶液不反应,且溶液也呈碱性,会加重腐蚀性;
C、稀硫酸能与氢氧化钠反应,但硫酸本身也有较强的腐蚀性;
D、石灰水不与氢氧化钠反应,且本身也有较强的腐蚀性;故选A;
(2)①氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,滴加过程中产生的明显现象产生蓝色沉淀;
②加氢氧化钠溶液至40g时,溶液里含有的溶质硫酸铜有剩余,溶液中的溶质为剩余的硫酸铜和生成的硫酸钠;
③设溶液中硫酸铜的质量为x

![]()
x=16g
硫酸铜溶液的质量分数![]() 。
。

【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图1)。
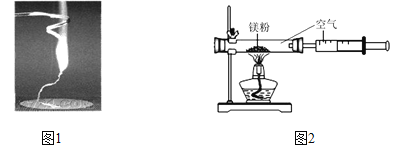
(1)请写出镁条与氧气反应的化学方程式___________________。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是 __________________________。
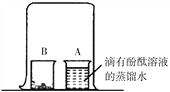
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
【做出猜想】黄色固体为Mg3N2
【实验探究】
实验操作 | 实验现象及结论 |
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:_______________。 结论:燃烧产物中含Mg3N2 |
【反思与交流】
①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释。
___________________________________________________。
②空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释____________________。
【拓展延伸】
①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数_____1/5(填“大于”、“小于”或“等于”)。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量可能是______。
A. 3.33g B. 4.00g C. 3.28g D. 3.96g
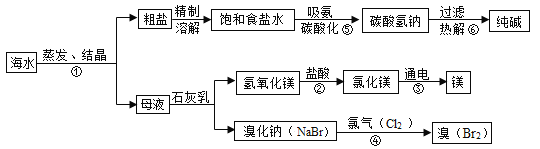
【题目】海水是巨大的资源宝库,如下图所示利用海水为原料可获得许多化工产品,下表为部分物质的溶解度,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 |
NaHCO3 | 8.2 | 9.6 | 11.1 | 12.70 | |
NH4Cl | 33.2 | 37.21 | 41.4 | 45.8 |
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是____________。
(2)步骤②发生反应的化学方程式是________,其基本反应类型为____________;步骤③中是电能转化为__________能。
(3)步骤④是向溴化钠中通入氯气,生成溴单质和一种盐,发生的是置换反应,试写出该反应的化学方程式______________。
(4)步骤⑤中碳酸氢钠先结晶析出,原因是____________;进行生产时,先向饱和食盐水中通入氨气,再加压不断通人二氧化碳气体,其理由是____________。
(5)写出步骤⑥的化学方程式__________________。