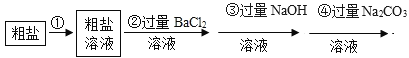ΧβΡΩΡΎ»ί
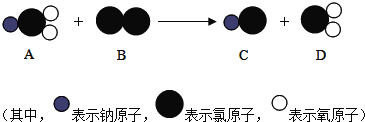
ΓΨΧβΡΩΓΩ“―÷ΣΡ≥Έό…ΪΜλΚœΤχΧε÷–Ω…ΡήΚ§”– CO2ΓΔCOΓΔH2OΓΔH2“Μ÷÷ΜρΦΗ÷÷Θ§œ÷“ά¥ΈΫχ––»γœ¬ Β―ι(ΦΌ…ηΟΩ¥Έ Β―ιΤχΧεΨυΆξ»ΪΖ¥”Π)ΘΚ
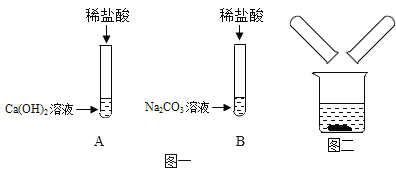
A Ά®Ιΐ≈®ΝρΥα ±Θ§ΤχΧεΧεΜΐ±δ–ΓΘΜ
B Ά®ΙΐΉΤ»»ΒΡ CuO ±Θ§ΙΧΧε±δΈΣΚλ…ΪΘΜ
C Ά®ΙΐΑΉ…ΪΝρΥαΆ≠ΖέΡ© ±Θ§ΖέΡ©±δΈΣάΕ…ΪΘΜ
D Ά®Ιΐ≥Έ«εΒΡ ·Μ“Υ° ±Θ§»ή“Κ±δΜκΉ«ΓΘ
Θ®1Θ©ΗυΨί¥Υ Β―ιΙΐ≥ΧΚΆ Β―ιœ÷œσΘ§‘≠ΜλΚœΤχΧεΒΡΉι≥…÷–“ΜΕ®”–___________ΘΜ
Θ®2Θ©–¥≥ω≤Ϋ÷ηB÷–Ω…ΡήΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ___________Μρ___________ΓΘ
Θ®3Θ©–¥≥ω≤Ϋ÷ηCΚΆD÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ___________ΚΆ___________ΓΘ
ΓΨ¥πΑΗΓΩH2OΚΆH2 CuOΘΪH2![]() CuΘΪH2O COΘΪCuO
CuΘΪH2O COΘΪCuO![]() CuΘΪCO2 CuSO4ΘΪ5H2O=CuSO4ΓΛ5H2O CO2ΘΪCa(OH)2=CaCO3ΓΐΘΪH2O
CuΘΪCO2 CuSO4ΘΪ5H2O=CuSO4ΓΛ5H2O CO2ΘΪCa(OH)2=CaCO3ΓΐΘΪH2O
ΓΨΫβΈωΓΩ
A Ά®Ιΐ≈®ΝρΥαΘ®Η…‘οΦΝΘ© ±Θ§ΤχΧεΧεΜΐ±δ–ΓΘΜΜλΚœΤχΧε÷–”–Υ°ΘΜ
B Ά®ΙΐΉΤ»»ΒΡ CuO ±Θ§ΙΧΧε±δΈΣΚλ…ΪΘΜΥΒΟςΜλΚœΤχΧε÷–÷Ν…Ό”–«βΤχΜρ“Μ―θΜ·ΧΦΤδ÷–“Μ÷÷ΘΜ
C Ά®ΙΐΑΉ…ΪΝρΥαΆ≠ΖέΡ© ±Θ§ΖέΡ©±δΈΣάΕ…ΪΘΜΥΒΟς”–Υ°≤ζ…ζΘ§‘ρΜλΚœΤχΧε÷–“ΜΕ®”–«βΤχΘ§«βΤχΜΙ‘≠―θΜ·Ά≠≤ζ…ζΆ≠ΚΆΥ°ΘΜ
D Ά®Ιΐ≥Έ«εΒΡ ·Μ“Υ° ±Θ§»ή“Κ±δΜκΉ«Θ§Εΰ―θΜ·ΧΦΡή Ι ·Μ“Υ°±δΜκΉ«Θ§ΒΪ≤ΜΡή»ΖΕ® «‘≠ΜλΚœΤχΧε÷–”–Εΰ―θΜ·ΧΦΘ§ΜΙ «“Μ―θΜ·ΧΦΜΙ‘≠―θΜ·Ά≠≤ζ…ζΆ≠ΚΆΕΰ―θΜ·ΧΦΘΜ
Θ®1Θ©ΗυΨί¥Υ Β―ιΙΐ≥ΧΚΆ Β―ιœ÷œσΘ§‘≠ΜλΚœΤχΧεΒΡΉι≥…÷–“ΜΕ®”–ΘΚΥ°ΚΆ«βΤχΘΜ
Θ®2Θ©≤Ϋ÷ηB÷–ΖΔ…ζΒΡΖ¥”Π ««βΤχ”κΉΤ»»ΒΡ―θΜ·ΧζΖ¥”Π≤ζ…ζΆ≠ΚΆΥ°ΒΡΜ·―ßΖΫ≥Χ ΫΘΚCuOΘΪH2![]() CuΘΪH2OΜρ“Μ―θΜ·ΧΦ”κΉΤ»»ΒΡ―θΜ·Ά≠Ζ¥”Π≤ζ…ζΆ≠ΚΆΕΰ―θΜ·ΧΦΒΡΜ·―ßΖΫ≥Χ ΫΘΚCOΘΪCuO
CuΘΪH2OΜρ“Μ―θΜ·ΧΦ”κΉΤ»»ΒΡ―θΜ·Ά≠Ζ¥”Π≤ζ…ζΆ≠ΚΆΕΰ―θΜ·ΧΦΒΡΜ·―ßΖΫ≥Χ ΫΘΚCOΘΪCuO![]() CuΘΪCO2ΓΘ
CuΘΪCO2ΓΘ
Θ®3Θ©≤Ϋ÷ηCΝρΥαΆ≠”κΥ°Ζ¥”Π≤ζ…ζΈεΥ°ΝρΥαΆ≠ΒΡΜ·―ßΖΫ≥Χ ΫΘΚCuSO4ΘΪ5H2O=CuSO4ΓΛ5H2OΚΆ≤Ϋ÷ηDΕΰ―θΜ·ΧΦ”κ«β―θΜ·ΗΤΖ¥”Π≤ζ…ζΧΦΥαΗΤΚΆΥ°ΒΡΜ·―ßΖΫ≥Χ ΫΘΚCO2ΘΪCa(OH)2=CaCO3ΓΐΘΪH2OΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΫΪ““¥ΦΚΆ―θΤχ÷Ο”ΎΟή±’»ίΤς÷–“ΐ»ΦΘ§≤βΒΟΖ¥”Π«ΑΚσΗςΈο÷ ΒΡ÷ ΝΩ»γœ¬ΘΚ
Έο÷ Θ®¥ΩΨΜΈοΘ© | ““¥Φ | ―θΤχ | Εΰ―θΜ·ΧΦ | Υ° | X |
Ζ¥”Π«Α÷ ΝΩ/g | 2.3 | 4 | 0 | 0 | 0 |
Ζ¥”ΠΚσ÷ ΝΩ/g | 0 | 0 | 2.2 | 2.7 | ¥ΐ≤β |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
A.X÷–“ΜΕ®Κ§”–ΧΦ‘ΣΥΊΚΆ―θ‘ΣΥΊ
B.Ζ¥”ΠΚσXΒΡ÷ ΝΩΈΣ1.5g
C.X÷–“ΜΕ®Κ§”–ΧΦ‘ΣΥΊΚΆ«β‘ΣΥΊ
D.X÷–ΝΫ÷÷‘ΣΥΊΒΡ÷ ΝΩ±»ΈΣ1:1
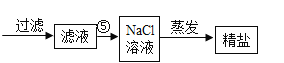
ΓΨΧβΡΩΓΩΡ≥Μ·―ß–Υ»Λ–ΓΉι‘ΎΧΫΨΩœΓ―ΈΥαΒΡΜ·―ß–‘÷ ±Θ§ΉωΝΥ»γΆΦ“ΜΥυ ΨΒΡΝΫΗω Β―ιΘΚ
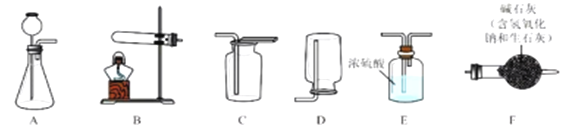
Θ®1Θ©–¥≥ω B ‘Ιή÷–Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ___________ΘΜ
Θ®2Θ© Β―ιΫα χΚσΘ§–ΓΉιΆ§―ßΫΪ AΓΔB ΝΫ÷ß ‘Ιή÷–ΒΡΖœ“ΚΆ§ ±ΒΙ»κ“ΜΗωΫύΨΜΒΡ…’±≠÷–Θ®»γΆΦΕΰΥυ ΨΘ©Θ§ Ιέ≤λΒΫœ»”–Τχ≈ί≤ζ…ζΘ§Κσ”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…ΓΘΆ§―ßΟ«ΫΪ…’±≠ΡΎΒΡΈο÷ Ϋχ––Ιΐ¬ΥΘ§Ε‘ΥυΒΟ¬Υ“ΚΒΡ»ή÷ ≥… Ζ÷Ϋχ––ΧΫΨΩΘΚ
Θ®Ής≥ω≤¬œκΘ©
ΦΉΆ§―ß≤¬œκΘΚNaCl
““Ά§―ß≤¬œκΘΚNaClΓΔCaCl2ΓΔHCl
±ϊΆ§―ß≤¬œκΘΚNaClΓΔCaCl2
ΕΓΒΡ≤¬œκ «ΘΚ_____________
Θ®≤ι‘ΡΉ ΝœΘ©NaClΓΔCaCl2 »ή“ΚΨυ≥ ÷––‘ΓΘ
Θ®ΫΜΝςΧ÷¬έΘ©
ΦΉΆ§―ß»œΈΣ_____________Ά§―ßΒΡ≤¬œκ“ΜΕ®≤Μ’ΐ»ΖΘ§άμ”… «ΘΚ______________ΘΜ
Θ®…ηΦΤ Β―ιΘ©±ϊΓΔΕΓΝΫΈΜΆ§―ßΖ÷±π…ηΦΤ»γœ¬ Β―ι―ι÷ΛΉ‘ΦΚΒΡ≤¬œκΘΚ
Β―ιΖΫΑΗ | Β―ι≤Ϋ÷η | Β―ιœ÷œσ | Β―ιΫα¬έ |
±ϊ | »Γ…ΌΝΩ¬Υ“Κ”Ύ ‘Ιή÷–Θ§œρΤδ÷–ΒΈΦ”Έό…ΪΖ”ΧΣ ‘“Κ | ΈόΟςœ‘œ÷œσ | ≤¬œκ’ΐ»Ζ |
ΕΓ | »Γ…ΌΝΩ¬Υ“Κ”Ύ ‘Ιή÷–Θ§œρΤδ÷–ΒΈΦ” ΝΩœΓ―ΈΥα | _____ | ≤¬œκ’ΐ»Ζ |
Θ®Ζ¥ΥΦΤάΦέΘ©
Β―ιΫα χΚσΘ§ΦΉΆ§―ß»œΈΣ_____Θ®ΧνΓΑ±ϊΓ±ΜρΓΑΕΓΓ±Θ©Ά§―ßΒΡ Β―ιΫα¬έ «¥μΈσΒΡΘ§άμ”… «__________________ΓΘ
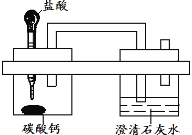
ΓΨΧβΡΩΓΩΈ“Ιζ÷χΟϊΜ·―ßΦ“ΚνΒ¬Αώœ»…ζΖΔΟςΝΥΓΑΚν œ÷ΤΦνΖ®Γ±Θ§Τδ‘≠άμ÷–÷Ί“ΣΒΡ“Μ≤Ϋ «œρ±ΞΚΆ ≥―ΈΥ°÷–œ»ΚσΆ®»κΉψΝΩNH3ΚΆCO2÷Τ±ΗNaHCO3Θ§Μ·―ßΖΫ≥Χ ΫΘΚNaCl+ NH3+CO2+H2O= NaHCO3Γΐ+NH4Cl
Ρ≥–Υ»Λ–ΓΉι‘Ύ Β―ι “ΡΘΡβΗΟΙΐ≥ΧΘ§«κΫαΚœΨΏΧεΒΡ≤Ϋ÷ηΜΊ¥πœ¬Ν–Έ ΧβΘΚ
IΘ°ΤχΧε÷Τ±Η
Θ®1Θ©Εΰ―θΜ·ΧΦΤχΧε÷Τ±Η
Β―ι “≥Θ≤…”Ο ·Μ“ ·”κœΓ―ΈΥαΖ¥”Π÷Τ±ΗCO2Θ§ΤδΜ·―ßΖΫ≥Χ ΫΈΣ_____________ΓΘ”Π―Γ‘ώΒΡΤχΧε ’Φ·ΉΑ÷ΟΈΣ______(―ΓΧνΉΑ÷ΟΕ‘”ΠΒΡΉ÷ΡΗ)ΓΘ
Θ®2Θ©Α±Τχ÷Τ±Η
Β―ι “≥Θ”ΟΝρΥαΈϋ ’Α±ΤχΘ§Ζά÷ΙΈέ»ΨΩ’ΤχΘ§ Β―ι “÷Τ±ΗNH3ΒΡΖ¥”Π‘≠άμΈΣΘΚCa(OH)2(ΙΧ)+2NH4Cl(ΙΧ) ![]() CaCl2+2H2O+2NH3ΓϋΓΘœ÷“Σ÷Τ±Η≤ΔΗ…‘οNH3Θ§Υυ―ΓΉΑ÷ΟΒΡ’ΐ»ΖΝ§Ϋ”Υ≥–ρΈΣ_____Γζ______(―Γ‘ώΉΑ÷ΟΕ‘”ΠΒΡΉ÷ΡΗ)ΓΘ Β―ι “÷Τ±ΗO2“≤Ω…”Ο…œ ω÷Τ±ΗNH3ΒΡΖΔ…ζΉΑ÷ΟΘ§–¥≥ω”ΟΗΟΖΔ…ζΉΑ÷Ο÷Τ±ΗO2ΒΡΜ·―ßΖΫ≥Χ Ϋ__________ΓΘ
CaCl2+2H2O+2NH3ΓϋΓΘœ÷“Σ÷Τ±Η≤ΔΗ…‘οNH3Θ§Υυ―ΓΉΑ÷ΟΒΡ’ΐ»ΖΝ§Ϋ”Υ≥–ρΈΣ_____Γζ______(―Γ‘ώΉΑ÷ΟΕ‘”ΠΒΡΉ÷ΡΗ)ΓΘ Β―ι “÷Τ±ΗO2“≤Ω…”Ο…œ ω÷Τ±ΗNH3ΒΡΖΔ…ζΉΑ÷ΟΘ§–¥≥ω”ΟΗΟΖΔ…ζΉΑ÷Ο÷Τ±ΗO2ΒΡΜ·―ßΖΫ≥Χ Ϋ__________ΓΘ
IIΘ°NaHCO3÷Τ±Η
Έο÷ | NaHCO3 | NH4Cl |
»ήΫβΕ»/g(20Γφ) | 9.6 | 37.2 |
Θ®3Θ©ΗυΨί±μΗώ÷–ΒΡ»ήΫβΕ» ΐΨίΘ§Ϋβ Ά20Γφ≤ζΈο÷–NaHCO3ΡήΙΜœ»¥”»ή“Κ÷–ΫαΨßΈω≥ωΒΡ‘≠“ρ________ΓΘ
Θ®4Θ©ΗΟΙΐ≥Χ÷–Νμ“Μ≤ζΈοNH4Cl‘Ύ≈©“Β…ζ≤ζ÷–≥Θ±Μ”ΟΉς______________ΓΘ