题目内容
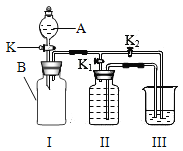
【题目】(6分)微型化学实验使用药品的量很少,产生的废弃物也很少,因此被誉为绿色环保的化学实验。用如图微型仪器完成制取并检验CO2的实验只消耗了0.55 g 10%的盐酸。求:(1)产生CO2的质量是多少克?(结果保留三位小数)(2)如果10%的盐酸密度为1.1g/cm3,消耗盐酸的体积是多少毫升?(3)通常完成这个实验大约需10%的盐酸5 mL,这是微型实验用药量的多少倍?
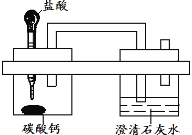
【答案】(1)设生成二氧化碳的质量为x。
CaCO2+2HCl=CaCl2+H2O+CO2↑(1分)
73 44
0.55 g×10% x
![]() ==
==![]() (1分)
(1分)
X=0.033g (1分)
(2)消耗盐酸的体积为![]() =0.5mL(2分)
=0.5mL(2分)
(3)它是微型实验用药量的![]() =10(倍)(1分)
=10(倍)(1分)
答:(1)生成二氧化碳的质量为0. 033 g
(2)消耗盐酸的体积为0. 5 mL
(3)是微型实验用药量的10倍。
【解析】根据碳酸钙与盐酸反应的化学方程式和元素的质量,列出比例式,就可计算出生成二氧化碳的质量;根据“体积=质量÷密度”计算即可;通常完成这个实验所用盐酸的体积÷微型实验用药的体积,就是倍数.
(1)设生成二氧化碳的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
0.55g×10% x
∴73:44=(0.55g×10%):x,
解之得:x=0.033g;
(2)消耗盐酸的体积是:0.55g÷1.1g/cm3=0.5mL;
(3)5mL÷0.5mL=10.
答:(1)产生CO2的质量是0.033g;
(2)消耗盐酸的体积是0.5mL;
(3)这是微型实验用药量的10倍.
本题主要考查学生运用化学方程式和质量、密度与体积的关系综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力

 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】我市石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品10.0g于烧杯中,将100g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下.
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体质量/g | 8.0 | 6.0 | 4.0 | 2.5 | X |
请计算:(1)X的值为__________.
(2)该石灰石样品中碳酸钙的质量分数为_____________
(3)所用稀盐酸溶质的质量分数为________.(写出计算过程)