题目内容
【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的两个实验:
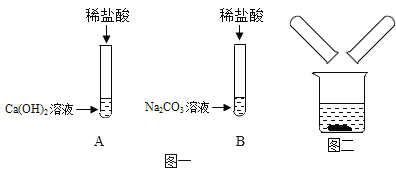
(1)写出 B 试管中反应的化学方程式___________;
(2)实验结束后,小组同学将 A、B 两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示), 观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成 分进行探究:
(作出猜想)
甲同学猜想:NaCl
乙同学猜想:NaCl、CaCl2、HCl
丙同学猜想:NaCl、CaCl2
丁的猜想是:_____________
(查阅资料)NaCl、CaCl2 溶液均呈中性。
(交流讨论)
甲同学认为_____________同学的猜想一定不正确,理由是:______________;
(设计实验)丙、丁两位同学分别设计如下实验验证自己的猜想:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
丙 | 取少量滤液于试管中,向其中滴加无色酚酞试液 | 无明显现象 | 猜想正确 |
丁 | 取少量滤液于试管中,向其中滴加适量稀盐酸 | _____ | 猜想正确 |
(反思评价)
实验结束后,甲同学认为_____(填“丙”或“丁”)同学的实验结论是错误的,理由是__________________。
【答案】![]() NaCl、Na2CO3 乙 产生的白色沉淀是碳酸钙,碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,两者不可能共存 有气泡产生 丙 如果滤液中溶质只有氯化钠,氯化钠显中性,滴加无色酚酞试液,也不变色
NaCl、Na2CO3 乙 产生的白色沉淀是碳酸钙,碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,两者不可能共存 有气泡产生 丙 如果滤液中溶质只有氯化钠,氯化钠显中性,滴加无色酚酞试液,也不变色
【解析】
(1)B试管中,碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:![]() ;
;
作出猜想:
A试管中:![]() ;B试管中:
;B试管中:![]() ,实验结束后,小组同学将 A、B 两支试管中的废液同时倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。有气泡产生,说明B试管中碳酸钠过量,A试管中稀盐酸过量,碳酸钠与稀盐酸反应生成二氧化碳,后有白色沉淀生成,说明碳酸钠先与A中剩余的稀盐酸反应,待稀盐酸反应后,再与A中反应生成的氯化钙反应生成碳酸钙和水,同学们将烧杯内的物质进行过滤,得到滤液,如碳酸钠和氯化钙恰好完全反应,则滤液中溶质只有氯化钠,如碳酸钠过量,则滤液中溶质有氯化钠、碳酸钠,如氯化钙过量,则滤液中溶质有氯化钠、氯化钙,故丁的猜想是:NaCl、Na2CO3;
,实验结束后,小组同学将 A、B 两支试管中的废液同时倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。有气泡产生,说明B试管中碳酸钠过量,A试管中稀盐酸过量,碳酸钠与稀盐酸反应生成二氧化碳,后有白色沉淀生成,说明碳酸钠先与A中剩余的稀盐酸反应,待稀盐酸反应后,再与A中反应生成的氯化钙反应生成碳酸钙和水,同学们将烧杯内的物质进行过滤,得到滤液,如碳酸钠和氯化钙恰好完全反应,则滤液中溶质只有氯化钠,如碳酸钠过量,则滤液中溶质有氯化钠、碳酸钠,如氯化钙过量,则滤液中溶质有氯化钠、氯化钙,故丁的猜想是:NaCl、Na2CO3;
交流讨论:
甲同学认为乙同学的猜想一定不正确,理由是:产生的白色沉淀是碳酸钙,碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,两者不可能共存;
设计实验:
丁的结论为:猜想正确,故滤液中溶质的成分是:NaCl、Na2CO3,取少量滤液于试管中,向其中滴加适量稀盐酸,碳酸钠与稀盐酸反应生成氯化钠、二氧化碳和水,故实验现象是:有气泡产生;
反思评价:
实验结束后,甲同学认为丙同学的实验结论是错误的,理由是:如果滤液中溶质只有氯化钠,氯化钠显中性,滴加无色酚酞试液,也不变色。

【题目】小兰用图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶(甲)中注入过量的NaOH溶液,振荡集气瓶后打开止水夹. (不考虑微溶物)
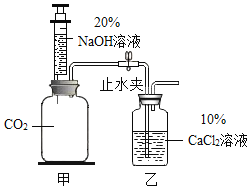
(1)向甲中注入NaOH溶液发生的化学反应方程式为_____。
(2)打开止水夹后观察到:_____。上述现象证明CO2能与NaOH发生化学反应。
(3)反应后将甲中混合物过滤,得到白色沉淀和无色滤液。
小兰欲探究无色滤液中的溶质成分:小兰分析得出无色滤液中一定含_____ 。(填化学式)
[提出问题]无色滤液中还含有哪些溶质?
[做出猜想]①Na2CO3 ②CaCl2; ③CaCl2和Na2CO3; ④无其他溶质。
小兰认为猜想_____一定不正确。(填序号)
[进行实验]
实验步骤 | 实验现象 | 实验结论 |
I.取少量滤液于试管中,滴加少量_____溶液 | 无明显现象 | 猜想④成立 |
Ⅱ.另取少量滤液于试管中,滴加足量稀盐酸 | 无明显现象 |
[实验交流]
小梅将步骤II中盐酸由“足量”改为“少量”进行实验,没有观察到气泡(其他步骤和现象不变),小梅认为猜想④成立,小梅的实验错误的原因是_____(用化学方程式表示)。