题目内容
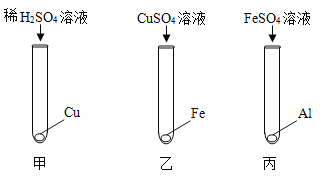
【题目】兴趣小组在探究金属的化学性质时,进行实验并将实验情况记录如下。
甲组 | 乙组 | ||
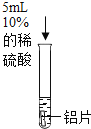
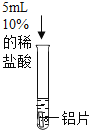
实验操作 |
| 实验操作 |
|
实验现象 | 无明显现象 | 实验现象 | 铝片表面有气泡产生 |
实验结论 | —— | 实验结论 | 用化学方程式表示产生气泡的原因:_____ |
(提出问题)甲组实验中为什么没有气泡产生?
(猜想与假设)铝表面的氧化膜阻止了铝和稀硫酸反应的发生。
(进行实验)
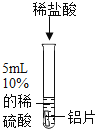
实验操作 | 实验现象 | 实验结论 |
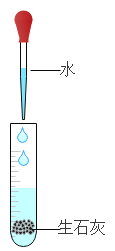
将打磨后的铝片放入试管中,加入5mL 10%的稀硫酸。 | 有气泡产生 | 铝表面的氧化膜阻止了铝与稀硫酸反应的发生 |
(反思与评价)乙组实验中使用的铝片也有氧化膜,却观察到有气泡产生。同学们认为可能是盐酸中的氯离子对反应产生了影响,设计以下实验继续探究。
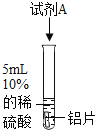
实验序号 | 1 | 2 | 3 |
实验操作 |
|
|
|
实验现象 | 有气泡产生 | 有气泡产生 | 无明显现象 |
(1)实验1不能证明“盐酸中的氯离子对反应产生影响”,理由是_____。
(2)对比实验2和实验3,能证明“盐酸中的氯离子对反应产生影响”。试剂A是_____溶液(填序号,下同),试剂B是_____溶液。
A 硫酸铜 B 氯化钠 C 硫酸钠 D 氯化锌
(拓展延伸)若要验证金属铁、铜、铝的活动性强弱,只需一种试剂直接与上述三种金属反应就能达到目的,该试剂可选用_____溶液(填序号)。
a.稀盐酸 b.硫酸铜 c.氯化铝 d.硫酸亚铁
【答案】2Al+6HCl=2AlCl3+3H2↑ 盐酸也能与铝片反应产生气体 B C ad
【解析】
甲中无明显现象,说明铝不能和10%的稀硫酸反应;
乙中产生气泡,是因为铝和盐酸反应生成氯化铝和氢气,反应的化学方程式:![]() 。
。
反思与评价:
(1)实验1不能证明“盐酸中的氯离子对反应产生影响”,理由是盐酸也能与铝片反应产生气体。
(2)对比实验2和实验3,能证明“盐酸中的氯离子对反应产生影响”。试剂A是氯化钠溶液,试剂B是硫酸钠溶液;故填:B;C。
拓展延伸:
把金属分别放入稀盐酸中时,产生气泡最快的是铝,产生气泡较慢的是铁,不产生气泡的是铜;
把金属铜、铝分别放入硫酸亚铁溶液中时,铜表面无明显现象,说明铜不能和硫酸亚铁反应,即铁比铜活泼,铝表面析出黑色固体,说明铝能和硫酸亚铁反应,即铝比铁活泼;
由以上分析可知,若要验证金属铁、铜、铝的活动性强弱,可以用稀盐酸、硫酸亚铁溶液;故填:ad。

 习题精选系列答案
习题精选系列答案