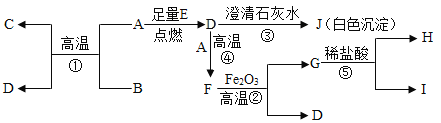
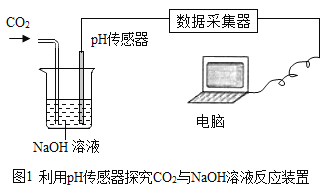
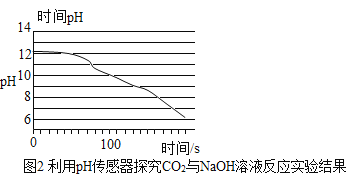
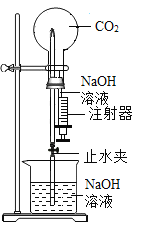
题目内容
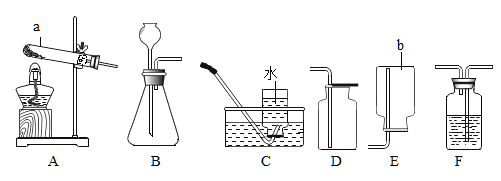
【题目】实验室中用如下实验来研究铁、铝、铜三种金属活动顺序及其在活动顺序表中相对氢的位置。
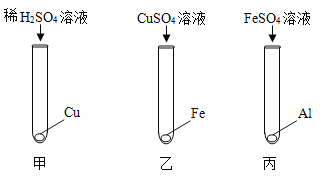
(1)乙实验的现象为___________________。
(2)丙实验中反应的化学方程式___________________。
(3)若将上述实验之一替换掉一种药品,即可达成实验目的.说明具体的改进方法:___________________。
(4)按如图实验结束后,将乙、丙实验后的剩余物倾倒至一个烧杯中, 充分反应。然后将甲实验的剩余物倒入此烧杯,无气泡产生。以下说法正确的是___________________。
A 最后烧杯中的溶液不可能是无色的
B 乙实验中,CuSO4溶液一定是过量的
C 乙、丙混合过程中,可能没有发生化学反应
D 最后烧杯中的溶液,一定含有Al2 (SO4) 3,可能含有FeSO4。
【答案】有红色固体生成,溶液由蓝色变为浅绿色 ![]() 将乙中
将乙中![]() 溶液换成稀
溶液换成稀![]() 溶液 AB
溶液 AB
【解析】
铁能与硫酸铜反应生成铜和硫酸亚铁,铝与硫酸亚铁反应生成硫酸铝和铁,铁和稀硫酸反应生成硫酸亚铁和氢气。
(1) )乙实验发生的反应为铁与硫酸铜反应生成铜和硫酸亚铁,故现象为铁表面附着红色固体,溶液由蓝色变为浅绿色。
(2)丙实验中铝与硫酸亚铁反应生成硫酸铝和铁,反应的化学方程式为![]() 。
。
(3)铁排在氢的前面,铜排在氢的后面,铁和稀硫酸反应生成硫酸亚铁和氢气,铜和稀硫酸不反应,故可以将乙实验中的硫酸铜溶液换为稀硫酸。
(4)A、将甲实验的剩余物倒入此烧杯,无气泡产生,说明剩余物无铁和铝;故溶液中要含有亚铁离子,最后烧杯中的溶液不可能是无色的,故A正确;
B、乙、丙实验后的剩余物倾倒至一个烧杯中剩余物无铁和铝,说明乙实验中, ![]() 溶液一定是过量的,故B正确;
溶液一定是过量的,故B正确;
C、乙、丙实验后的剩余物倾倒至一个烧杯中剩余物无铁和铝,则乙、丙混合过程中,一定发生化学反应,故C不正确;
D、溶液中要含有亚铁离子,最后烧杯中的溶液不可能是无色的,最后烧杯中的溶液,一定不含有硫酸亚铁,故D不正确。故选 AB。

【题目】兴趣小组在探究金属的化学性质时,进行实验并将实验情况记录如下。
甲组 | 乙组 | ||
实验操作 |
| 实验操作 |
|
实验现象 | 无明显现象 | 实验现象 | 铝片表面有气泡产生 |
实验结论 | —— | 实验结论 | 用化学方程式表示产生气泡的原因:_____ |
(提出问题)甲组实验中为什么没有气泡产生?
(猜想与假设)铝表面的氧化膜阻止了铝和稀硫酸反应的发生。
(进行实验)
实验操作 | 实验现象 | 实验结论 |
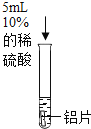
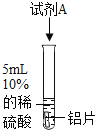
将打磨后的铝片放入试管中,加入5mL 10%的稀硫酸。 | 有气泡产生 | 铝表面的氧化膜阻止了铝与稀硫酸反应的发生 |
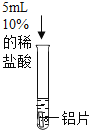
(反思与评价)乙组实验中使用的铝片也有氧化膜,却观察到有气泡产生。同学们认为可能是盐酸中的氯离子对反应产生了影响,设计以下实验继续探究。
实验序号 | 1 | 2 | 3 |
实验操作 |
|
|
|
实验现象 | 有气泡产生 | 有气泡产生 | 无明显现象 |
(1)实验1不能证明“盐酸中的氯离子对反应产生影响”,理由是_____。
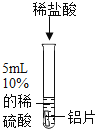
(2)对比实验2和实验3,能证明“盐酸中的氯离子对反应产生影响”。试剂A是_____溶液(填序号,下同),试剂B是_____溶液。
A 硫酸铜 B 氯化钠 C 硫酸钠 D 氯化锌
(拓展延伸)若要验证金属铁、铜、铝的活动性强弱,只需一种试剂直接与上述三种金属反应就能达到目的,该试剂可选用_____溶液(填序号)。
a.稀盐酸 b.硫酸铜 c.氯化铝 d.硫酸亚铁