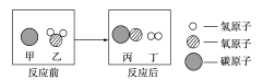
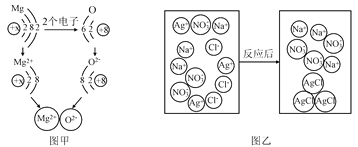
题目内容
【题目】某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说法正确的是

A. 图中c点所示溶液呈碱性
B. 图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C. 该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
D. 由a点到b点的pH变化过程证明酸和碱发生了中和反应
【答案】D
【解析】试题分析∶由题中信息知,A.图中c点所示溶液呈酸性。故A错误。B.图中a点所示溶液中,含有的溶质是Na2SO4和NaOH.故B错误。C.该实验是将硫酸逐滴滴入到盛有的氢氧化钠溶液烧杯中。故C错误。D.由a点到b点的pH变化过程证明酸和碱发生了中和反应。故D正确。
考点∶考查硫酸和氢氧化钠中和反应溶液pH的变化图像。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】实验室有一瓶标签受到腐蚀(如图所示)的无色溶液,老师请各小组同学开展探究。
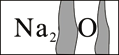
【提出问题】这瓶无色溶液究竟是什么物质的溶液?
【猜想与假设】经了解得知,这瓶无色溶液原是放在存放盐溶液的柜子里。
由此猜测:这瓶无色溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液。
【理论分析】为了确定该溶液,他们首先进行了分析:
甲同学根据标签上的组成元素认为一定不可能是溶液______________。
乙同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是__________________。
【设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验。
实验操作 | 实验现象 |
①取少量该无色溶液于试管中,慢慢滴加BaCl2溶液。 ②静置、过滤,向白色沉淀中滴加__________。 | 产生白色沉淀。 产生大量气泡,沉淀消失。 |
【实验结论】
该瓶无色溶液的溶质是_________,生成白色沉淀的化学方程式是_______________。
【实验反思】
丙同学认为原设计的实验还可简化,同样达到鉴别的目的。丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
实验操作 | 实验现象 |
取少量该无色溶液于试管中,_______________________________________________。 | ______________________ |
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】为保证实验准确性,实验所用金属片均用砂纸打磨,打磨目的主要是:______________________________。
实验⑴为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为_____________________________。
从实验现象可判断:金属活动性Zn_______Fe(填“<”、“=”或“>”)。
【得出结论1】
金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是_____________________________________________________。
实验⑵为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是__________。
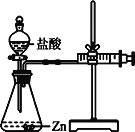
所用药品、实验数据如下表:
实验 编号 | 选用金属 (均取2g) | 盐酸质量分数 (均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2 分钟 | 2﹣3 分钟 | 3﹣4 分钟 | 4﹣5 分钟 | 前5分 钟共收 集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论2】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是________________。
[注意:若答对下面小题奖励4分,化学试卷总分不超过60分]
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快原因:_________________再由快到慢的原因是_________________。
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?
因素1:_______________________________。
因素2:_______________________________。