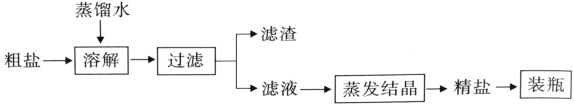
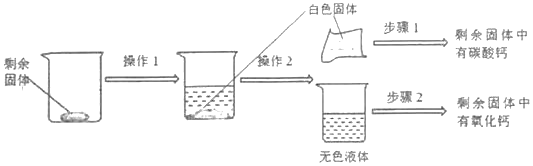
题目内容
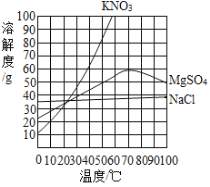
【题目】如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
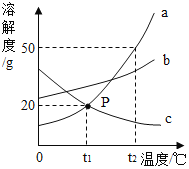
A. P点表示t1℃时,a、c饱和溶液中溶质质量相等
B. t2℃时,将30ga物质加入到50g水中充分搅拌,得到80ga的饱和溶液
C. t2℃时等质量的三种饱和溶液降温至t1℃,所得溶液中溶剂质量c>b>a
D. 将t1℃时a、b、c三种物质的溶液分别升温至t2℃,其溶质质量分数都不可能发生变化
【答案】C
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A、P点表示t1℃时,a、c两种物质的溶解度相等,饱和溶液的质量不能确定,溶液中溶质质量不能确定,故A错误;B、t2℃时,a物质的溶解度是50g,t2℃时,100g水中最多溶解50ga,将30g a物质加入到50g水中充分搅拌,只能溶解25ga,得到75g a的饱和溶液,故B错误;C、t2℃时,a物质的溶解度最大,b物质次之,c物质最小,所以等质量的三种饱和溶液中,溶液中溶剂质量c>b>a,降温至t1℃,溶剂质量不变,所得溶液中溶剂质量c>b>a,故C正确;D、将t1℃时a、b、c三种物质的溶液分别升温至t2℃,c物质会析出晶体,溶质质量分数减小,故D错误。故选C。

 智趣寒假作业云南科技出版社系列答案
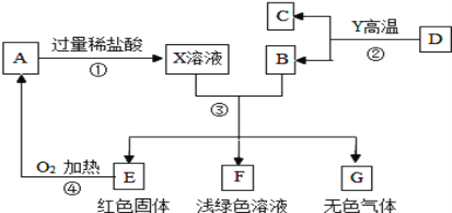
智趣寒假作业云南科技出版社系列答案【题目】某研究性学习小组将铁粉投入盛有硫酸铜溶液的试管中,发现生成红色固体物质的同时有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
(查阅资料)SO2易溶于水,能与NaOH反应,生成Na2SO3。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是_____。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。
(3)实验小组同学合作设计了如图1实验方案,对提出的猜想进行验证。
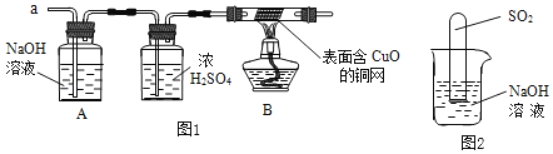
①如果放出的是O2和H2,你认为方案中的安全隐患是_____。
②丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指堵住试管口,_____,若不发出尖锐的爆鸣声,方可采用上面的装置进行实验。
(实验探究)经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(实验结论)铁粉与硫酸铜溶液反应时,产生的气体是_____。
(思维拓展)
(4)由上述实验可以推出,硫酸铜溶液中可能含有_____物质(填酸性、中性或碱性)。
(5)写出装置B中所发生反应的方程式
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?
丁同学设计了如图2所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是_____。
(定量探究)该研究性学习小组的同学在教师的指导下,设计如下实验方案对硫酸铜溶液进行定量探究。
A.量取100mL上述硫酸铜溶液,倒入放在电子天平上的烧杯中,然后加入20.00g铁粉,充分搅拌,有关实验数据记录如下:
称量项目 | 称量时间 | 质量/g |
烧杯 | 55.65 | |
烧杯+硫酸铜溶液 | 215.65 | |
烧杯+硫酸铜溶液+铁粉 | 30s | 235.59 |
烧杯+硫酸铜溶液+铁粉 | 60s | 235.45 |
烧杯+硫酸铜溶液+铁粉 | 90s | 235.45 |
B.90s后,将烧杯中的物质经“过滤,洗涤、干燥、称量”,得滤渣15.2g。
C.取少量滤渣于试管中,加入稀硫酸,观察到有气泡产生。
(7)请根据实验现象和有关数据,回答下列问题:
①加入铁粉后,用玻璃棒不断搅拌的原因是_____。
②计算上述硫酸铜溶液中CuSO4的质量分数_____。(写出计算过程。)