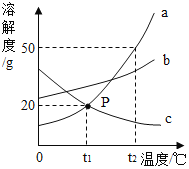
题目内容
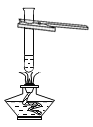
【题目】某同学为探究煅烧了一段时间的石灰石中剩余固体的成分(杂质不参与反应),进行了以下实验:
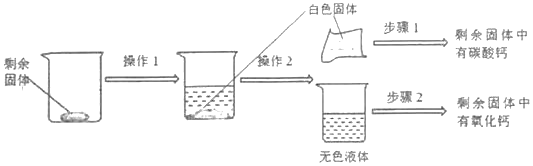
①写出煅烧石灰石反应的化学方程式______;
②操作1为加水溶解,操作2为______;
③步骤1:取白色固体少许,滴加过量的稀盐酸,观察到的现象为______;
④步骤2:取无色液体少许,______;
⑤操作2所得白色固体的成分为______。
【答案】CaCO3![]() CaO+CO2
CaO+CO2![]() 过滤; 有气泡产生; 滴加了2~3滴无色酚酞试液;(观察到溶液呈红色) 一定有CaCO3和杂质,可能有Ca(OH)2;
过滤; 有气泡产生; 滴加了2~3滴无色酚酞试液;(观察到溶液呈红色) 一定有CaCO3和杂质,可能有Ca(OH)2;
【解析】
①石灰石的主要成分为CaCO3,煅烧石灰石生成氧化钙和二氧化碳,方程式为CaCO3![]() CaO+CO2;
CaO+CO2;
②操作2是将固体和液体分离,是过滤操作;
③步骤1得到的结论是剩余固体中有碳酸钙,因此,取白色固体少许,滴加过量的稀盐酸,观察到的现象是有气泡产生;
④步骤2得到的结论是固体中含有氧化钙,所以无色液体中含有氢氧化钙,检验氢氧化钙的方法是:滴加了2~3滴无色酚酞试液(观察到溶液呈红色),或通入二氧化碳气体(观察是否有沉淀生成);
⑤由步骤1得到,固体中含有碳酸钙固体,由步骤2得到,固体中含有氧化钙,所以般烧了一段时间的石灰石中剩余固体的成分为碳酸钙和氧化钙,则经过操作1溶解之后,氧化钙与水反应生成氢氧化钙,氢氧化钙在水中的溶解度很低,所以经过过滤,白色固体中可能还含有氢氧化钙,所以一定有CaCO3和杂质,可能有Ca(OH)2。

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目