题目内容
【题目】A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系。请回答:
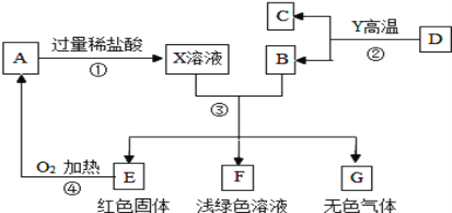
⑴写出物质的化学式:A________;B_________,X溶液中的溶质是__________(填化学式)。
⑵写出反应①的化学方程式:_________,反应④的实验现象_________。
⑶C和D的化学性质不同,其原因是_________。
⑷如图转化中产生无色气体G的原因是________(用化学方程式表示)。
⑸A与G反应的基本类型是__________。
【答案】CuO Fe CuCl2、HCl CuO+2HCl==CuCl2+H2O 红色固体表面变黑 分子构成不同 Fe+2HCl==FeCl2+H2↑ 置换反应
【解析】
反应②是炼铁工业中的主要反应,B是单质,则B是Fe,C是CO2。E是红色固体单质,则E是Cu,F是浅绿色溶液,则F是FeCl2。反应④是2Cu+O2![]() 2CuO,A是CuO,反应①是CuO+2HCl==H2O+CuCl2 ,因为加入过量稀盐酸,所以X溶液中的溶质是CuCl2、HCl。Fe+2HCl==FeCl2+H2↑,G是H2。
2CuO,A是CuO,反应①是CuO+2HCl==H2O+CuCl2 ,因为加入过量稀盐酸,所以X溶液中的溶质是CuCl2、HCl。Fe+2HCl==FeCl2+H2↑,G是H2。
⑴A是CuO,B是 Fe,X溶液中的溶质是CuCl2、HCl。
⑵反应①的化学方程式是:CuO+2HCl==H2O+CuCl2 ,反应④的化学方程式是:2Cu+O2![]() 2CuO,铜是红色固体,氧化铜是黑色固体,所以实验现象是红色固体表面变黑。
2CuO,铜是红色固体,氧化铜是黑色固体,所以实验现象是红色固体表面变黑。
⑶C是CO2,D是CO,它们的化学性质不同,其原因是分子构成不同。
⑷如图转化中产生H2的原因是Fe+2HCl==FeCl2+H2↑。
⑸A是CuO,G是H2,它们之间反应的化学方程式为:H2 +CuO![]() Cu+H2O,由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应。
Cu+H2O,由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】同学们在初中化学实验室中,发现一瓶如图所示久置的瓶口有白色固体、瓶塞丢失的无色溶液。已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定溶液成分,同学们进行了如下探究:
(1)探究成分
①小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是____。他取少量待测液于试管中,加入过量的稀HCl,看到_________,由此小张同学认为,溶液为Na2CO3溶液。
②小李同学对小张同学的结论提出疑问,拟进行了以下实验:取少量待测液于试管中,加入过量的BaCl2溶液,生成白色沉淀,该反应方程式为__________,过滤,取滤液,(写出还需进行的操作及现象)___________。通过实验,小李认为小张结论不正确。
③同学们通过讨论认为试剂瓶原标签应该是氢氧化钠,但因吸收空气中 ______的而变质。
(2)测定碳酸钠的浓度
取该试剂瓶中溶液50g倒入烧杯中,再向烧杯中逐滴滴加盐酸使其充分反应至无气泡产生(假设生成的二氧化碳全部逸出)。测得加入盐酸的质量与烧杯中的物质的质量关系如下表所示。
累计加入盐酸的质量/g | 0 | 25 | 37.5 | 50 |
烧杯中物质的总质量/g | 50 | 75 | 85.3 | 97.8 |
请你计算:
①这一测定过程中产生二氧化碳质量为_______g。
②这一瓶试剂中碳酸钠的质量分数_______(写出计算过程)。