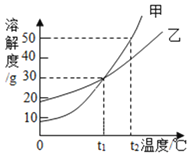
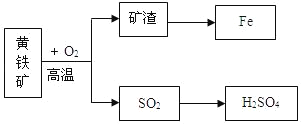
题目内容
【题目】A~G是七种初中常见的化学物质,其中 A、B、C、D、E分别是五种不同类别(即单质、氧化物、酸、碱、盐)的物质,D和F由两种相同的元素组成,E的粉末为黑色(其中“→”表示一种物质可以通过一步反应转化为另一种物质,部分反应物、生成物、反应条件已省略)。请写出:
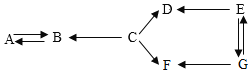
(1)F的化学式_____。
(2)B→A反应的化学方程式为_____。
【答案】FeCl3 H2O+CaO=Ca(OH)2
【解析】
因为E的粉末为黑色,所以E可能为C、CuO、Fe粉,假设E为Fe粉单质,进行推导,D可能为FeCl2,由于D、F含有相同的元素,所以F可能为FeCl3,C能经过反应生成D、F,C可能为HCl,C、D、E分别为酸、盐、单质,所以A、B分别为氧化物和碱其中的一种,所以B为氧化物,A为碱。酸和碱反应可以生成盐和水,所以B可能是H2O,A可能是Ca(OH)2。反推证明推导过程正确。
(1)由分析可知,F的化学式为FeCl3;
(2)B→A 反应的化学方程式为:H2O+CaO=Ca(OH)2。

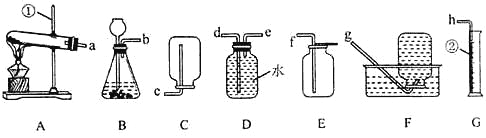
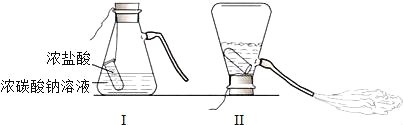
【题目】化学实验过程经常会产生一定量的废液,经过无害化处理可有效防止水体污染。在一次实验课上,兴趣小组的同学们完成了NaOH溶液和Na2CO3溶液的鉴别,并对废液成分展开探究。
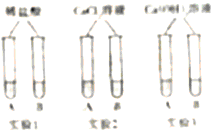
活动一
通过小组合作,同学们完成了右图所示的三组小实验。实验中生成白色沉淀的化学方程式是____________________(写一个)。
活动二
小雪将六支试管中的剩余物倒入一个洁净的大烧杯中(如下图), 充分搅拌、静置。观察到杯内上层是无色溶液,下层有白色沉淀。由此可以确定:上层溶液中一定不含有的离子是__________________、以及一定含有的离子。小组同学对上层溶液中还可能含有的离子进行了如下探究。![]()
(提出问题)上层溶液中还可能含有什么离子?
(猜想与假设)上层溶液中还可能含有OH-、CO32-、Ca2+中的一种或几种。
(进行实验)
实验步骤 | 实验现象 | 实验结论 | |
方案一 | ①取少量溶液于试管中,滴加无色酚酞溶液②继续滴加稀盐酸 | ①溶液变红 ②产生气泡 | ①有OH- ②有CO32-、无Ca2+ |
方案二 | 取少量溶液于试管中,____________(指示剂除外) | ①____________ ②___________ | ①有CO32-、无Ca2+ ②有OH- |
(反思与评价)
(1)小明同学对方案一提出质疑, 他的理由是________________________。
(2)经过综合分析,最终确定上层溶液中肯定存在的离子有______________________。
(3)将烧杯内物质过滤,滤渣回收,向滤液中加入适量_______________________进行处理后再排放。
【题目】阅读下面的科普材料。
在人类社会的发展过程中,金属起着重要的作用。从五千年前使用的青铜器,三千年前进入铁器时代,直到20世纪铝合金成为仅次于铁的金属材料,金属材料对于促进生产发展、改善人类生活发挥了巨大的作用。
金属材料包括纯金属和它们的合金。合金具有许多优良的物理性质、化学或机械性能,在许多方面不同于各成分金属。例如:合金的硬度可以大于它的纯金属成分,熔点也可以低于它的成分金属。而且,使用不同的原料,或原料的配比不同,就可以得到具有不同性能的合金。
青铜是我国使用最早的合金。东汉铜奔马身高34.5厘米,身长45厘米,宽13厘米,重7.15千克。形象矫健俊美,别具风姿。充分体现了我国光辉灿烂的古代科技。除青铜外,常见的还有黄铜(含锌及少量的锡、铅、铝等)和白铜(含镍、锌及少量的锰)等合金。
除少数金属外,大多数金属在自然界中都是以化合物的形式存在。为了能够提供人类所需的金属材料,就需要将金属从矿石中冶炼出来。我国古代就发明了湿法炼铜的方法,就是用铁将铜从硫酸铜溶液中置换出来,我国是最早使用该方法的国家。
随着科技水平和冶炼工艺的不断提高,目前,常见的冶炼方法主要有以下几种:
冶炼方法 | 反应表示式(其他生成物略去) | 代表性金属 |
热还原法 | 金属A的氧化物+碳(或一氧化碳等) | 锌、铜 |
电解法 | 金属B的化合物 | 镁、铝 |
热分解法 | 金属C的氧化物 | 汞、银 |
工业上就是利用一氧化碳还有赤铁矿冶炼得到金属铁。
金属材料应用广泛。钛合金是一种性能非常优越的金属,它的化学性质稳定,耐腐蚀,尤其是抵抗海水腐蚀能力很强,目前广泛用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域。
人类每年要从自然界提取数以亿吨计的金属的同时,大量的金属却因腐蚀而报废。每年因腐蚀而报废的金属设备和材料相当于年产量的20%﹣40%.防止金属的腐蚀已成为科学研究和技术领域中的重大问题。回答下列问题:

(1)金属可以做炊具,利用了金属的___性。
(2)赤铁矿石属于___(填“纯净物”“混合物”。)
(3)根据材料,写出工业用氯化镁冶炼镁的化学方程式___。
(4)为了防止金属腐蚀,可以在金属表面附着保护膜,其原理是___。
(5)下列方法,不能鉴别黄铜和纯铜的是___。
A 刻划法 B AgNO3溶液 C HCl D NaNO3溶液
(6)现将一定量的Zn、Fe 投入到含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后,过滤得到滤渣和滤液。向滤渣中加入稀硫酸,无明显现象,则溶液中可能有的物质是(写化学式)___。