��Ŀ����
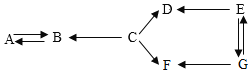
����Ŀ����ҵ���û�����ʯ����Ҫ�ɷ�FeS2�������������������ڷ���¯�б��գ�����һϵ�еķ�Ӧ�õ����ᣮ���պ�Ŀ�����������������ת��������ͼ��
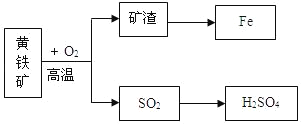
��ش���������
��1����ȫ����FeS2�Ļ�ѧ����ʽ��4FeS2+11O2![]() 2_____+8SO2����
2_____+8SO2����
��2���ÿ��������Ļ�ѧ����ʽ_____��
��3��д����Ȼ����ij��������γ����꣨SO2��H2SO4����һ��;���ķ�Ӧԭ��_____��
��4���������������ķ�����_____��
��5��������ת����������Ԫ�س��ֵĻ��ϼ���_____��
��6��úȼ�չ�����Ҳ�������������Ϊ��ֹ������Ⱦ����ҵ�ϱ���������������䷴Ӧԭ���У�2CaCO3+2SO2+O2�T2CaSO4+2CO2����Ҫ����32kg�Ķ����������壬��������Ҫ̼��Ƶ�����Ϊ_____��
��7���û�����ʯ������Σ����_____��
���𰸡�Fe2O3 3CO+Fe2O3![]() 2Fe+3CO2 2SO2+O2
2Fe+3CO2 2SO2+O2 2SO3��SO3+H2O��H2SO4 �����������м�����ʯ�� ��1��+4��+6 50kg ������Ⱦ�����Ķ�������
2SO3��SO3+H2O��H2SO4 �����������м�����ʯ�� ��1��+4��+6 50kg ������Ⱦ�����Ķ�������
��������
��1���ڷ�Ӧǰԭ�ӵ��������Ŀ�ֱ�Ϊ��Fe��4����O��22����S��8������Ӧ��ԭ�ӵ��������Ŀ�ֱ�Ϊ��S��8����O��16�������Ը��ݻ�ѧ��Ӧǰ��ԭ�ӵ��������Ŀ����ɵã�2���շ����к��и�4��Fe��6��O������1���к���2��Fe��3��O����ѧʽΪFe2O3��
���Fe2O3��
��2����ҵ���������û�ԭ��һ����̼���������ڸ����·�Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ3CO+Fe2O3![]()
![]() 2Fe+3CO2�����3CO+Fe2O3
2Fe+3CO2�����3CO+Fe2O3![]() 2Fe+3CO2��
2Fe+3CO2��
��3�����������ڴ������������ܺ�������Ӧ���������������������ˮ��Ӧ���������ᣬ��Ӧ�Ļ�ѧ����ʽ�ֱ�Ϊ��2SO2+O2 2SO3��SO3+H2O��H2SO4�����2SO2+O2
2SO3��SO3+H2O��H2SO4�����2SO2+O2 2SO3��SO3+H2O��H2SO4��
2SO3��SO3+H2O��H2SO4��
��4������������������������кͷ�Ӧ�������������м���������ʣ�����ʯ�ң���ʯ�������������е��ᣨ�����ᣩ��Ӧ��������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Ca��OH��2+H2SO4�TCaSO4+2H2O��
�ʴ�Ϊ�������������м�����ʯ�ң�
��5���ڶ���������FeS2�� �У�����Ϊ+2���ڻ��������������ϼ۴�����Ϊ�㣬����Ϊ��1�ۣ���SO2�У���Ϊ��2�ۣ�����Ϊ+4�ۣ���SO3�У���Ϊ��2�ۣ�����Ϊ+6�ۣ���H2SO4��Ϊ+6�ۣ�������ת����������Ԫ�س��ֵĻ��ϼ��ǩ�1��+4��+6���𰸣���1��+4��+6��
��6������Ҫ̼��Ƶ�����Ϊx��

x��50kg
���50kg��
��7���û�����ʯ�����Ĺ������ܲ������������������ж�����Ⱦ�������𰸣�������Ⱦ�����Ķ�������

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�����Ŀ��һ�ܱ��������мס��ҡ��������������ʣ���һ�������·�����ѧ��Ӧ��һ��ʱ���÷�Ӧǰ��������������±�������˵����ȷ���ǣ�������
���� | �� | �� | �� | �� |
��Ӧǰ���ʵ�����/g | 4 | 16 | 6 | 2 |
��Ӧ�����ʵ�����/g | 8 | 1 | x | 12 |
A. ��Ӧ�����������غ㶨��
B. ��Ϊ��Ӧ���Ϊ������������Ǹ÷�Ӧ�Ĵ���
C. �μӷ�Ӧ���ҺͶ���������Ϊ2��3
D. ��֪�Ͷ��Ļ�ѧʽ��֮��Ϊ2��5����ʽ�м��붡�Ļ�ѧ������֮��Ϊ1��1