��Ŀ����
����Ŀ���Ķ�����Ŀ��ղ��ϡ�
���������ķ�չ�����У�����������Ҫ�����á�����ǧ��ǰʹ�õ���ͭ������ǧ��ǰ��������ʱ����ֱ��20�������Ͻ��Ϊ���������Ľ������ϣ��������϶��ڴٽ�������չ����������������˾�����á�
�������ϰ��������������ǵĺϽ𡣺Ͻ���������������������ʡ���ѧ���е���ܣ�������治ͬ�ڸ��ɷֽ��������磺�Ͻ��Ӳ�ȿ��Դ������Ĵ������ɷ֣��۵�Ҳ���Ե������ijɷֽ��������ң�ʹ�ò�ͬ��ԭ�ϣ���ԭ�ϵ���Ȳ�ͬ���Ϳ��Եõ����в�ͬ���ܵĺϽ�
��ͭ���ҹ�ʹ������ĺϽ𡣶���ͭ��������34.5���ף�����45���ף���13���ף���7.15ǧ�ˡ�����ý���������߷��ˡ�����������ҹ���Բ��õĹŴ��Ƽ�������ͭ�⣬�����Ļ��л�ͭ(��п������������Ǧ������)�Ͱ�ͭ(������п����������)�ȺϽ�
�����������⣬�������������Ȼ���ж����Ի��������ʽ���ڡ�Ϊ���ܹ��ṩ��������Ľ������ϣ�����Ҫ�������ӿ�ʯ��ұ���������ҹ��Ŵ��ͷ�����ʪ����ͭ�ķ���������������ͭ������ͭ��Һ���û��������ҹ�������ʹ�ø÷����Ĺ��ҡ�
���ſƼ�ˮƽ��ұ�����յIJ�����ߣ�Ŀǰ��������ұ��������Ҫ�����¼��֣�
ұ������ | ��Ӧ��ʾʽ(������������ȥ) | �����Խ��� |
�Ȼ�ԭ�� | ����A��������+̼(��һ����̼��) | п��ͭ |
��ⷨ | ����B�Ļ����� | þ���� |
�ȷֽⷨ | ����C�������� | ������ |
��ҵ�Ͼ�������һ����̼���г�����ұ���õ���������
��������Ӧ�ù㷺���ѺϽ���һ�����ܷdz���Խ�Ľ��������Ļ�ѧ�����ȶ�����ʴ�������ǵֿ���ˮ��ʴ������ǿ��Ŀǰ�㷺���ڷɻ���������������������Ǻ�����ɴ�������
����ÿ��Ҫ����Ȼ����ȡ�����ڶּƵĽ�����ͬʱ�������Ľ���ȴ��ʴ�����ϡ�ÿ����ʴ�����ϵĽ����豸�Ͳ����൱���������20%��40%����ֹ�����ĸ�ʴ�ѳ�Ϊ��ѧ�о��ͼ��������е��ش����⡣�ش��������⣺

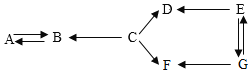
(1)�������������ߣ������˽�����___�ԡ�
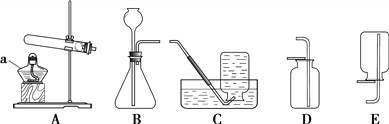
(2)������ʯ����___(�����������������������)
(3)���ݲ��ϣ�д����ҵ���Ȼ�þұ��þ�Ļ�ѧ����ʽ___��
(4)Ϊ�˷�ֹ������ʴ�������ڽ������渽�ű���Ĥ����ԭ����___��
(5)���з��������ܼ����ͭ�ʹ�ͭ����___��
A �̻��� B AgNO3��Һ C HCl D NaNO3��Һ
(6)�ֽ�һ������Zn��Fe Ͷ�뵽����Cu(NO3)2��AgNO3�Ļ����Һ�У���ַ�Ӧ���˵õ���������Һ���������м���ϡ���ᣬ��������������Һ�п����е�������(д��ѧʽ)___��
���𰸡����� ����� MgCl2![]() Mg+Cl2�� ����������ˮ BD Cu(NO3)2��AgNO3
Mg+Cl2�� ����������ˮ BD Cu(NO3)2��AgNO3
��������
��1���������������ߣ������˽����ĵ����ԣ�
��2��������ʯ����Ҫ�ɷ������������������������ʣ����ڻ���
��3����ͨ��������£�MgCl2�����ֽⷴӦ����þ����������Ӧ�Ļ�ѧ����ʽΪ��MgCl2![]() Mg+Cl2����
Mg+Cl2����
��4��Ϊ�˷�ֹ������ʴ�������ڽ������渽�ű���Ĥ����ԭ���Ǹ���������ˮ��
��5��A��ͭ��Ӳ�ȴ���ͭ��Ӳ�ȣ����Կ��ÿ̻�������A��ȷ��
B ͭ��п������������������Ӧ�������𣬹�B����
C п�������ᷴӦ������������ͭ���ܣ����Լ��𣬹�C��ȷ��
D ͭ��п����������������Һ��Ӧ�������𣬹�D����ѡBD��
��6���ڽ����˳���У�п�������ã�����ͭ���ã�ͭ�������ã���һ������Zn��Fe Ͷ�뵽����Cu(NO3)2��AgNO3�Ļ����Һ�У�п�Ⱥ�������������ͭ��Ӧ�����ٺ�������������ͭ��Ӧ����ַ�Ӧ���˵õ���������Һ���������м���ϡ���ᣬ����������˵������п��ʣ�࣬���ֽ����У�������ã�����пһ��������������Ӧ������������ͭ����һ�������˷�Ӧ����Һ��һ�����������Σ����ܺ�������ͭ������������ѧʽ�ֱ�Ϊ��Cu(NO3)2��AgNO3��

����Ŀ��һ�ܱ��������мס��ҡ��������������ʣ���һ�������·�����ѧ��Ӧ��һ��ʱ���÷�Ӧǰ��������������±�������˵����ȷ���ǣ�������
���� | �� | �� | �� | �� |
��Ӧǰ���ʵ�����/g | 4 | 16 | 6 | 2 |
��Ӧ�����ʵ�����/g | 8 | 1 | x | 12 |
A. ��Ӧ�����������غ㶨��
B. ��Ϊ��Ӧ���Ϊ������������Ǹ÷�Ӧ�Ĵ���
C. �μӷ�Ӧ���ҺͶ���������Ϊ2��3
D. ��֪�Ͷ��Ļ�ѧʽ��֮��Ϊ2��5����ʽ�м��붡�Ļ�ѧ������֮��Ϊ1��1