题目内容
【题目】下面甲、乙是实验室制备CO2和某同学设计的验证CO2性质的实验装置图。
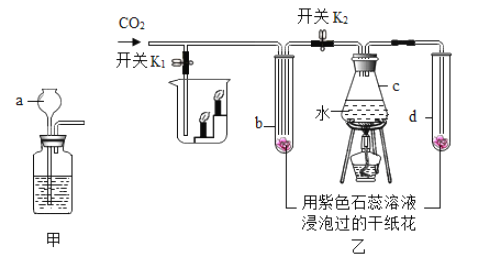
(1)标有字母a的仪器名称是_______.
(2)甲中发生反应的化学方程式是_______。
(3)乙中进行实验时,先关闭K1和K2,加热C一段时间后再通入CO2,观察到b、d中纸花均不变色。再打开K2,b中纸花逐渐变______,由此证明了二氧化碳能与水反应。若打开K1,还可以证明CO2具有的化学性质是_______。
【答案】长颈漏斗 CaCO3 +2HCl=CaCl2 +H2O + CO2↑ 红 不可燃不助燃
【解析】
(1)标有字母a的仪器名称是长颈漏斗;
(2)甲中发生反应是实验室制取二氧化碳,反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)乙中进行实验时,先关闭K1和K2,加热c,一段时间后再通入CO2,观察到b、d中纸花均不变色,说明水和二氧化碳都不能使纸花变色。再打开K2,b中纸花逐渐变红,由此证明了CO2能与水反应。若打开K1,可以观察到烧杯内的蜡烛由低到高依次熄灭,可以证明CO2具有的化学性质是不可燃、不助燃。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
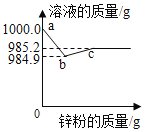
名题训练系列答案【题目】“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验 编号 | 硫酸的质量 分数(均取 20 mL) | 锌的形状 (均取1 g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式:________________________。
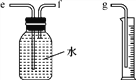
(2)小兵用如图所示装置收集并测量氢气的体积,其中量筒的作用是________________________________________,氢气应从________(填“e”“f”或“g”)管通入。
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________。
【得出结论】(4)结论是________________________________________________________________。
(5)下表是小兵第①组实验的详细数据。
时段(均 为1分钟) | 第1 分钟 | 第2 分钟 | 第3 分钟 | 第4 分钟 | 第5 分钟 | 第6 分钟 |
H2的体积 | 3.1 mL | 16.7 mL | 11.9 mL | 9.6 mL | 7.6 mL | 6.0 mL |
请描述锌与硫酸反应的快慢的变化并解释原因:______________________________。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。___________________。
【题目】以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 | 48.5 | 46.0 |
NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
A. 40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B. 60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C. 30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D. 20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
【题目】利用图所示装置(气密性良好)分别进行以下实验,最终U型管中两侧液面的相对高度不正确的是(加入试管中的试剂X所占体积忽略不计)
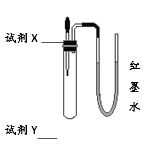
试剂X | 试剂Y | 相对高度 | |
A | 水 | 氧化钙(少量) | 左低右高 |
B | 过氧化氢溶液 | 二氧化锰(少量) | 左低右高 |
C | 稀盐酸 | 石灰石(少量) | 左低右高 |
D | 澄清石灰水 | 二氧化碳 | 左高右低 |
A. A B. B C. C D. D
【题目】小晨同学从课外读物中得知:在加热条件下,钠与CO2反应的产物可能有C、CO、Na2CO3、Na2O。于是设计实验对产物成分进行探究。
(查阅资料)①BaCl2溶液呈中性;②4Na+O2=2Na2O;③Na2O+H2O=2NaOH;④2Na+2H2O=2NaOH+H2↑;⑤CO通入PdCl2溶液中有黑色沉淀生成。
(提出问题)在加热条件下,钠与CO2反应的产物有哪些?
(猜想假设)猜想一:产物中一定有C 猜想二:产物中一定有CO
猜想三:产物中一定有Na2CO3 猜想四:产物中一定有Na2O
(实验验证)用下图所示装置(夹持装置已略去)进行实验探究。
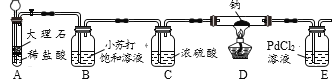
装置A中发生反应的化学方程式为_____;装置C的作用是_____。
序号 | 实验操作 | 实验现象 | 实验结论 |
(1) | 待钠完全反应后,将装置D中的固体置于烧杯中,加蒸馏水溶解 | 有黑色不溶物 | 猜想____正确 |
(2) | 将实验(1)所得混合物过滤,取滤液加入过量BaCl2溶液 | _____ | 猜想三正确 |
(3) | _____ | 猜想二正确 |
(反思与评价)小晨同学向实验(2)所得溶液中滴入几滴酚酞溶液,溶液呈红色。 于是得出结论:在加热条件下,钠与CO2反应一定产生Na2O。该结论是否严谨?____(填“是”或“否”),理由是____。