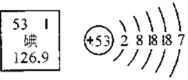
题目内容
【题目】小晨同学从课外读物中得知:在加热条件下,钠与CO2反应的产物可能有C、CO、Na2CO3、Na2O。于是设计实验对产物成分进行探究。
(查阅资料)①BaCl2溶液呈中性;②4Na+O2=2Na2O;③Na2O+H2O=2NaOH;④2Na+2H2O=2NaOH+H2↑;⑤CO通入PdCl2溶液中有黑色沉淀生成。
(提出问题)在加热条件下,钠与CO2反应的产物有哪些?
(猜想假设)猜想一:产物中一定有C 猜想二:产物中一定有CO
猜想三:产物中一定有Na2CO3 猜想四:产物中一定有Na2O
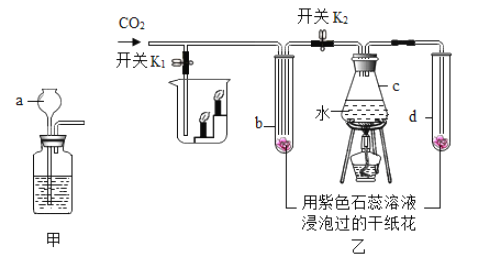
(实验验证)用下图所示装置(夹持装置已略去)进行实验探究。
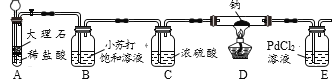
装置A中发生反应的化学方程式为_____;装置C的作用是_____。
序号 | 实验操作 | 实验现象 | 实验结论 |
(1) | 待钠完全反应后,将装置D中的固体置于烧杯中,加蒸馏水溶解 | 有黑色不溶物 | 猜想____正确 |
(2) | 将实验(1)所得混合物过滤,取滤液加入过量BaCl2溶液 | _____ | 猜想三正确 |
(3) | _____ | 猜想二正确 |
(反思与评价)小晨同学向实验(2)所得溶液中滴入几滴酚酞溶液,溶液呈红色。 于是得出结论:在加热条件下,钠与CO2反应一定产生Na2O。该结论是否严谨?____(填“是”或“否”),理由是____。
【答案】CaCO3+2HCl=CaCl2+CO2↑+H2O 吸收水蒸气(合理即可) 一 产生白色沉淀 E中产生黑色沉淀 否 实验装置中可能有空气,钠与空气中的氧气反应也产生Na2O(合理即可)
【解析】
实验验证:
大理石的主要成分为碳酸钙,装置A中碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;浓硫酸具有吸水性,装置C的作用是吸收水蒸气;
待钠完全反应后,将装置D中的固体置于烧杯中,加蒸馏水溶解,有黑色不溶物,是因为炭粉不溶于水;
若猜想三正确,产物中一定有Na2CO3,碳酸钠和氯化钡反应生成了碳酸钡沉淀和氯化钠,将实验(1)所得混合物过滤,取滤液加入过量BaCl2溶液,产生白色沉淀;
若猜想二正确,产物中一定有CO,根据“CO通入PdCl2溶液中有黑色沉淀生成”可知
E中产生黑色沉淀,实验过程如下所示:
序号 | 实验操作 | 实验现象 | 实验结论 |
(1) | 待钠完全反应后,将装置D中的固体置于烧杯中,加蒸馏水溶解 | 有黑色不溶物 | 猜想一正确 |
(2) | 将实验(1)所得混合物过滤,取滤液加入过量BaCl2溶液 | 产生白色沉淀 | 猜想三正确 |
(3) | E中产生黑色沉淀 | 猜想二正确 |
反思与评价:
该结论不严谨,理由是实验装置中可能有空气,钠与空气中的氧气反应也产生Na2O,Na2O与水反应生成氢氧化钠(或钠能和玻璃管中空气中的水蒸气反应生成氢氧化钠)。

【题目】有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 40 | 40 | 40 | 40 | 40 |
生成气体的总质量/g | 0.16 | m | 0.48 | 0.5 | 0.5 |
(1)表中m的值为_____。
(2)所用稀盐酸的溶质质量分数为多少?____