题目内容
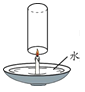
【题目】利用图所示装置(气密性良好)分别进行以下实验,最终U型管中两侧液面的相对高度不正确的是(加入试管中的试剂X所占体积忽略不计)
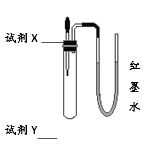
试剂X | 试剂Y | 相对高度 | |
A | 水 | 氧化钙(少量) | 左低右高 |
B | 过氧化氢溶液 | 二氧化锰(少量) | 左低右高 |
C | 稀盐酸 | 石灰石(少量) | 左低右高 |
D | 澄清石灰水 | 二氧化碳 | 左高右低 |
A. A B. B C. C D. D
【答案】A
【解析】
A、氧化钙(少量)溶于水放热,使瓶内气压增大,左边液面降低,一会又恢复原状,故A错误;
B、过氧化氢在二氧化锰的催化作用下反应生成氧气,使瓶内气压增大,左边液面降低,故B正确;
C、稀盐酸与石灰石(少量)反应生成二氧化碳,使瓶内气压增大,左边液面降低,故C正确;
D、澄清石灰水和二氧化碳反应,气体被消耗,使瓶内气压增大减小,左边液面上升,故D正确;故选A。

【题目】小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如图所示的装置进行实验探究,请你结合实验过程回答下列问题。
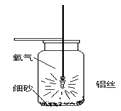
(1)集气瓶底预先铺少量沙子的目的是________。
(2)铝丝下端系一根火柴的目的是:________。
(3)用正确方法引燃铝丝,伸入装有氧气的集气瓶中后,未观察到铝丝发生剧烈燃烧现象,可能的原因是________。
(4)某化学兴趣小组的同学经查阅资料得知:人呼吸中各种气体的体积分数如表所示:
气体 | 吸入气体 | 呼出气体 |
X | 78% | 75% |
Y | 21% | 15% |
二氧化碳 | 0.03% | 3.68% |
水 | 0.02% | 5.44% |
其它 | 0.95% | 0.88% |
①请你判断:表中X是________,Y是________;
②欲证明人呼出的气体中含有水蒸气,其实验方法是___________。
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是________(填字母,下同)。
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可用于食品保鲜,称为“双吸剂”,因为它能吸收空气中的____和_____。
II.铁的冶炼 请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能_______。
Ⅲ.实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
(查阅资料):
①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:
H2C2O4 ![]() CO2
CO2![]() +CO
+CO![]() +H
+H![]() O
O
②NaOH溶液可以吸收二氧化碳, ③ 浓硫酸是一种常用的干燥剂。
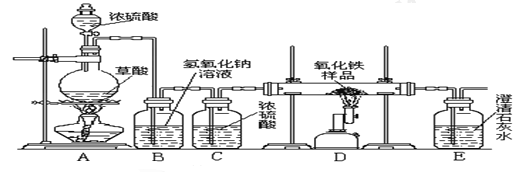
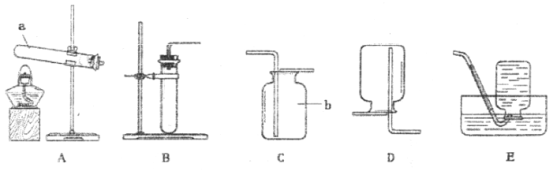
于是他设计了下图的实验装置,结合装置回答下列问题:
(1)图中装置C作用是_______________;
(2)装置E中澄清石灰水的作用是________________,该反应化学方程式为_____________;
(3)从实验操作程序和实验安全看,首先要检查装置的气密性,实验开始先加热__________(填A或D)处。实验结束应先停止加热该处,这样做的目的除了可防止生成的铁被氧化,还可以起到的目的是___________。
(4)该装置设计有一个明显缺陷,你认为是_________。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当D中固体全部变黑后,停止加热,继续通入CO直到玻璃管冷却。将得到的黑色固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
(查阅资料):a. 铁的氧化物在足量的稀盐酸中均能全部溶解,但无气泡产生。
b. Fe2O3与CO反应的固体生成物可能情况如下:
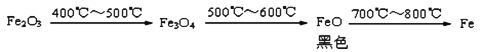
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;②__________ ;③Fe3O4 和Fe O 。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质量 | 玻璃管及其中固体的质量 | 装置E及其中物质的总质量 | |
反应前 | 28.20 g | 37.80g | 300.0 g |
反应后 | 37.48 g | 300.8 g |
根据上述数据,纯净的Fe2O3固体质量为_______ g,请选择有效的数据,推断出反应后黑色固体的成分 _____________, 根据推断结果,写出该实验中玻璃管内发生的化学反应方程式:_____________。
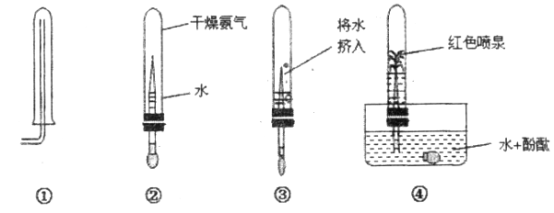
【题目】如图是木炭还原氧化铜的探究实验装置:
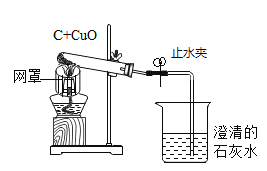
(提出问题)木炭还原氧化铜产生什么气体?
(提出猜想)产生的气体有三种情况:①CO;②CO2;③________。
(设计方案)实验前后分别对试管和烧杯里的物质进行称量,数据设计如下
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | M1 | M2 | △m1即(M1﹣M2) |
烧杯+澄清石灰水 | M3 | M4 | △m2即(M4﹣M3) |
(1)若△m2=0,说明反应产生的气体不能被澄清石灰水吸收,则猜想_____(填“①”、“②”或“③”)成立。
(2)若猜想②正确,理论上△m1与△m2的关系是:△m1_____△m2(填“>”、“<”或“=”)。
(实验并记录)实验得到的数据如下表:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | 69.89g | 65.49g | △m1 |
烧杯+澄清石灰水 | 118.9g | 122.6g | △m2 |
用以上实验数据分析,结果应该是猜想_______(填“①”、“②”或“③”)成立。
同学们对CO产生的原因进行了
原因一:木炭和氧化铜在高温条件下直接发生反应产生CO,反应方程式为:_________。
原因二:木炭和氧化铜在高温条件下反应中的一种产物和反应物木炭又发生了化学反应,产生了CO,反应方程式为:________。
(反思与评价)经查阅资料知道:木炭还原氧化铜产生CO2气体,反应化学方程式为:__________。
本次实验结果与资料显示不一致对其可能原因有同学提出下列分析,其中合理的是_______(填字母)。
A.装置漏气 B.生成的CO2部分与过量的C反应生成了CO
C.澄清石灰水吸收CO2效果不好 D.装置内还有CO2气体未被吸收
按本装置进行实验,待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却。若不关闭止水夹,可能出现的问题是________。
(定量分析)6克碳与一定质量的氧化铜恰好完全反应,生成的气体完全被足量的石灰水吸收,可得到沉淀________克。(要求:写出计算过程)