题目内容
【题目】某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。碱溶液可以使酚酞溶液变红,是因为碱在水溶液中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞溶液变红呢?他们设计了下图三个实验,请你和他们一起探究。
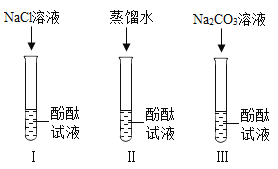
(1)实验Ⅰ可以证明_____。
(2)实验Ⅱ加入蒸馏水的目的是_____。小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是_____。
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到_____现象。由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞溶液变红。
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞溶液变红也是由于溶液中存在OH-。”你认为Na2CO3溶液存在OH-的原因是_____。
【答案】Na+不会使酚酞溶液变红 探究水分子是否能使酚酞溶液变红 酚酞溶液中就有水分子(或氯化钠溶液中含有水分子) 白色沉淀 碳酸根离子与水反应生成OH-(合理即可)
【解析】
(1)氯化钠中含有钠离子,氯化钠不能使酚酞变红,故实验Ⅰ可以证明:Na+不会使酚酞溶液变红;
(2)碳酸钠溶液中含有水分子,故实验Ⅱ加入蒸馏水的目的是:探究水分子是否能使酚酞溶液变红;
酚酞溶液和氯化钠溶液中均含有水分子,它们均不能使无色酚酞试液变色,故实验Ⅱ没有必要做,故填:酚酞溶液中就有水分子(或氯化钠溶液中含有水分子);
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,故除了红色逐渐消失,还观察到白色沉淀;
(4)碳酸根离子在溶液中会与水反应生成碳酸氢根和氢氧根,因此显碱性,能使无色酚酞试液变红,故Na2CO3溶液存在OH-的原因是:碳酸根离子与水反应生成氢氧根离子。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】复习硬水、软水及其自来水的软化知识时,某小组的同学们进行了如下探究。
知识回顾: (1)溶有较多可溶性钙镁化合物的水,叫硬水。
(2)硬水软化的原理是设法降低水中可溶性钙镁化合物的含量。
任务一:当地自来水是否为硬水?
(实验准备)取一定量当地自来水于烧杯中,滴加几滴稀盐酸酸化。
[进行实验]小组同学设计检验Mg2+、Ca2+实验方案如下:
实验步骤 | 实验操作 | 实验现象 |
I | 取少量烧杯中溶液于试管中,滴加足量的NaOH溶液 | ______ |
II | 取步骤I上层清液于另一试管中,滴加几滴_____ | 产生白色沉淀 |
(实验结论)当地自来水为硬水
(交流总结)实验步骤I、Ⅱ中发生反应的微观实质是_____(答出一点)。
任务二:自来水在煮沸后有水垢生成,水垢的主要成分是什么?
(猜想与假设)水垢中可能有碳酸钙。
(实验探究)小明收集热水壶内壁上的少量水垢于试管中,滴加_____,观察到有气泡产生,说明水垢中有碳酸钙。
(反思评价)
(1)除去水垢发生反应的化学方程式为_____;
(2)小红认为小明实验设计不合理,还要增加一个证明气体成分的实验,该设计是_____。
任务三:
(联系实际)小组同学走访许多工厂和家庭,了解到很多硬水软化的方法,并对硬水的危害有了更多的认识,联系实际,硬水软化的一种方法是_____,硬水的另一种危害是_____。