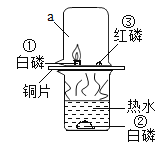
题目内容
【题目】下面是小婷同学测定黄铜(铜锌合金)中铜的质量分数的过程。小婷同学取10 g黄铜于烧杯中,将120 g稀硫酸分六次加入烧杯中,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
次数 | 一 | 二 | 三 | 四 | 五 | 六 |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量/g | 29.96 | 49.92 | m | 89.84 | 109.8 | 129.8 |
①10g黄铜完全反应产生H2的质量________g;
②表中m=________;
③求黄铜中铜的质量分数________ (写出计算过程)。
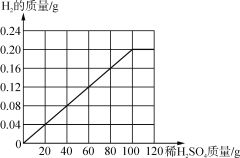
④请在如图画出10g黄铜加入稀硫酸与生成氢气的质量的图象________。
【答案】0.2 69.88 35% 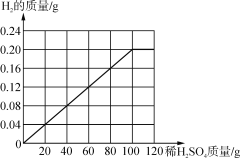
【解析】
①由表可知,反应前后生成氢气的质量为:120g+10g-129.8g=0.2g。
②由表可知,每20g的稀硫酸可以生成0.04g的氢气,故m=49.92g+20g-0.04g=69.88g。
③解:设参与反应的锌的质量为x。
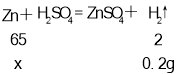
![]() =
=![]() x=6.5 g
x=6.5 g
则样品中铜的质量分数为![]() ×100%=35%
×100%=35%
答:该样品中铜的质量分数为35%。
④由表可知,每20g的稀硫酸可以生成0.04g的氢气,故图像为:

【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。